Lectures
Fibrilação Atrial em Portadores de Dispositivo de Terapia de Ressincronização Cardíaca
Padeletti , Luigi
Resumo
Introdução: A fibrilação atrial (FA) é associada com aumento da morbidade e mortalidade em pacientes com insuficiência cardíaca (IC). Pacientes com IC em classes III ou IV da New York Heart Association (NYHA), com disfunção sistólica e QRS largo, são candidatos a terapia de ressincronização cardíaca (TRC) e podem ser beneficiados pelo uso de estimulação de supressão atrial ou “overdrive atrial pacing” (AOP).
Métodos: O estudo MASCOT envolveu 409 portadores de dispostivo de TRC (79% homens), que foram randomizados em AOP ligado (n=197) e AOP desligado (n=197), e acompanhados por 1 ano. A idade média foi de 68±10 anos, a fração de ejeção (FE) de ventrículo esquerdo (VE) 25±6%, e a duração do QRS 163±29 ms. A classe III NYHA estava presente em 86% dos pacientes e 19% tinham história de FA paroxística. O desfecho primário do estudo foi a incidência de FA permanente em 1 ano.
Resultados: A AOP aumentou a percentagem de estimulação atrial de 30 para 80% (P<0.0001), foi bem tolerada, e não interferiu com a) a atuação de entrega de TRC (média de 95% de estimulação ventricular em ambos os grupos), b) resposta a TRC (70% responderam no grupo controle, contra 67% no grupo tratamento), ou c) função cardíaca (a FEVE aumentou de 24.5±6.2 % para 32.7±10.9 % no grupo controle, e de 25.8±6.8% para 33.1±12.6 % no grupo tratamento). A incidência de FA permanente foi de 3.3% em ambos os grupos. Por análise de regressão logística a história de FA (P<0.001) e a ausência de drogas antiarrítmicas (P=0.002) foram associadas com a FA permanente.
Conclusões: Neste primeiro estudo de um algoritmo de prevenção específica para FA em portadores de TRC, a AOP foi segura e não agravou a IC. O algoritmo de prevenção não diminuiu a incidência de FA em um 1 ano.
Palavras-chave: Terapia de ressincronização cardíaca – estimulação biventricular - estimulação multisitio – insuficiência cardíaca – fibrilação atrial
Introdução
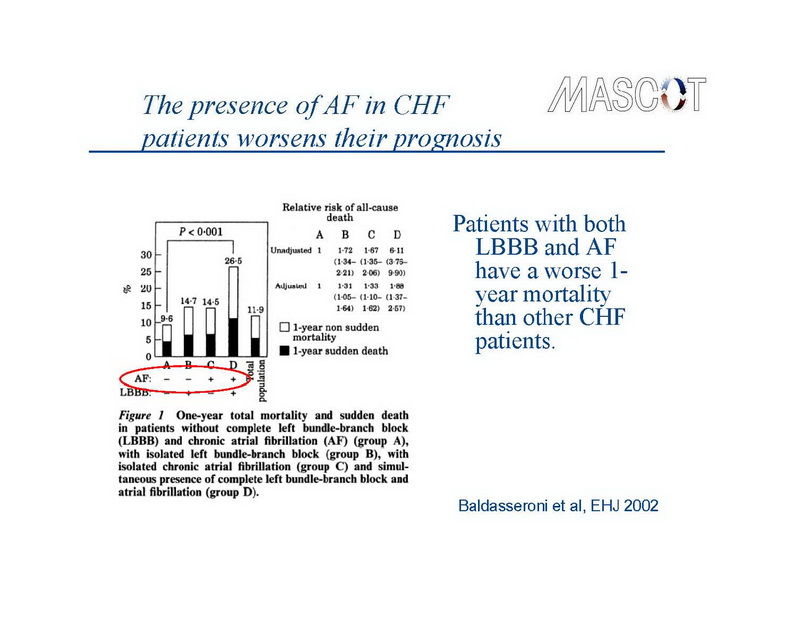
A fibrilação atrial (FA), a arritmia sustentada mais comum, e insuficiência cardíaca (IC), a principal causa de morbidade e mortalidade em países desenvolvidos, compartilham vários fatores de risco e frequentemente coexistem no mesmo paciente.1,2 A prevalência de ambas as doenças, cada uma causa independente de considerável mortalidade e morbidade, está aumentando. Além disso, o surgimento de uma predispõe diretamente a outra. Especificamente, a IC promove remodelamento atrial, e facilita o desenvolvimento da FA,3 enquanto os pacientes que desenvolvem FA em meio a IC apresentam maior morbidade e mortalidade do que aqueles que permanecem em ritmo sinusal,1,4 especialmente na presença de bloqueio de ramo esquerdo.5 (Slide 1,2,3)
A terapia de ressincronização cardíaca (TRC) alivia os sintomas, diminui a necessidade de hospitalizações, e melhora a função cardíaca e sobrevida em pacientes com IC moderada a grave devido a disfunção sistólica associada com dissincronia elétrica.6-9 Em poucos estudos, a TRC apenas, não diminui a incidência de FA,10,11 enquanto os episódios de FA resultaram em a) perda de ressincronização ou entrega subótima de terapia,12,13 b) menos remodelamento reverso, e c) pouca melhora na capacidade funcional. Algoritmos dedicados a estimulação têm sido realizados para prevenir FA por supressão contínua do ritmo atrial através de estimulação atrial direita com freqüência superior à freqüência cardíaca intrínseca. (Slide 4)
Estes algoritmos têm sido testados em várias populações de pacientes estimulados com resultados mistos,14-16 mas não especificamente em candidatos a TRC.
O estudo MASCOT foi definido para analisar se a adição da AOP à estimulação biventricular, resulta em efeito na incidência da FA permanente quando comparado apenas com a estimulação biventricular.17
Métodos
Desenho do estudo
Este estudo multicêntrico, cego, randomizado, paralelo, comparou a segurança e a eficácia de um algoritmo AOP específico (AF Suppression™, St Jude Medical, Sylmar, CA) em portadores de TRC. O protocolo do estudo foi revisado e aprovado pelo Comitê de Ética Institucional de cada centro participante, e todos os pacientes informados e concordantes com o termo de conscentimento. Após a implantação bem sucedida do dispositivo de TRC, e antes da alta hospitalar, os pacientes foram randomizados para AOP ligado e AOP desligado durante o período de seguimento (NCT00187252).
Definições
Os pacientes foram classificados como portadores de FA em início, se 1) se não tinham história de FA quando iniciaram participação no estudo, e 2) desenvolveram FA documentada por um eletrocardiograma durante o seguimento, ou durante um evento adverso ou hospitalização. Esta definição é semelhante a de Hoppe e colaboradores na análise retrospectiva do grupo de dados do CARE-HF.10 A FA permanente foi definida como FA de longa data para a qual a cardioversão não foi indicada ou tentada, como descrito nas diretrizes profissionais norte-americanas e européias para tratamento de pacientes com FA.18
Desfechos do estudo

O desfecho primário foi a incidência de FA permanente durante os 12 meses de seguimento. Os desfechos secundários foram 1) incidência de FA com início recente, 2) alterações na fração de ejeção (FE) de ventrículo esquerdo (VE) e dimensões, 3) alterações na classe funcional do New York Heart Association (NYHA) e na qualidade de vida (QV), avaliada pelo questionário Minnesota Living With Heart Failure® e 4) mortalidade.
Sistemas de terapia de ressincronização cardíaca
Todos os pacientes foram submetidos ao implante de um dispositivo TRC-P Frontier™ ou Frontier II, ou um dispositivo Epic™ HF ou Atlas™ HF (St Jude Medical). Todos os dispositivos incluem o algoritmo AF Suppression™. A função de AOP aumenta a taxa de estimulação quando 2 eventos atriais intrínsecos são detectados dentro de 16 ciclos. Uma vez alcançada a estimulação estável, o sistema estimula em taxa de supressão por 15 ciclos. Se, durante o período de AOP, ondas P intrínsecas são detectadas, o algoritmo aumenta novamente a taxa de estimulação em no máximo 110 epm. Se a onda P intrínseca não for detectada durante a AOP, o algoritmo aumenta o intervalo entre eventos estimulados consecutivos, lentificando gradualmente a taxa de estimulação para a frequência programada de base, ou para a frequência definida pelo sensor.
Seleção dos pacientes e randomização
Os pacientes eram elegíveis para participarem do estudo se preenchessem os seguintes critérios: 1) IC com classe funcional III ou IV (NYHA) apesar do tratamento medicamentoso otimizado, 2) duração do QRS ≥130 ms, 3) FEVE ≤35%, 4) diâmetro diastólico final de VE >55 mm. Os critérios de exclusão foram 1) FA permanete AF, 2) infarto do miocárdio, cirurgia cardíaca ou angioplastia coronária nos últimos 3 meses prévios ao estudo, 3) expectativa de vida <6 meses devido a outras doenças que não a IC, ou gravidez.
A randomização dos pacientes para os grupos tratamento e controle foi centralizada, realizada e coordenada pelo patrocinador do estudo.
Cálculo amostral
Pelo menos, 379 pacientes precisavam ser incluidos neste estudo para detectar um redução absoluta de 6.2% no desenvolvimento de FA permanente entre grupo tratamento e controle, nível de significância de 5%, com poder de 80%.
Análises estatísticas
Todas as análises foram baseadas no princípio “intenção de tratar”. Os dados colhidos nos dois grupos foram comparados em 12 meses. A normalidade dos dados foi verificada usando box-and-whisker, normal probability plos e testes Kolmogorov-Smirno para normalidade. As variáveis contínuas da distribuição normal foram comparadas usando 2 amostras de teste-t para variáveis independentes. Para as variáveis não-normais, foram usados dos testes não paramétricos de Wilcoxon-Mann-Whitney e Wilcoxon-signed-rank. As análises exploratórias de regressão logística foram realizadas para estimar o grau em que as variáveis selecionadas foram associadas independentemente com o desenvolvimento da FA permanente, ou morte por todas as causas. Um valor de P <0.05 foi considerado significante.
Resultados
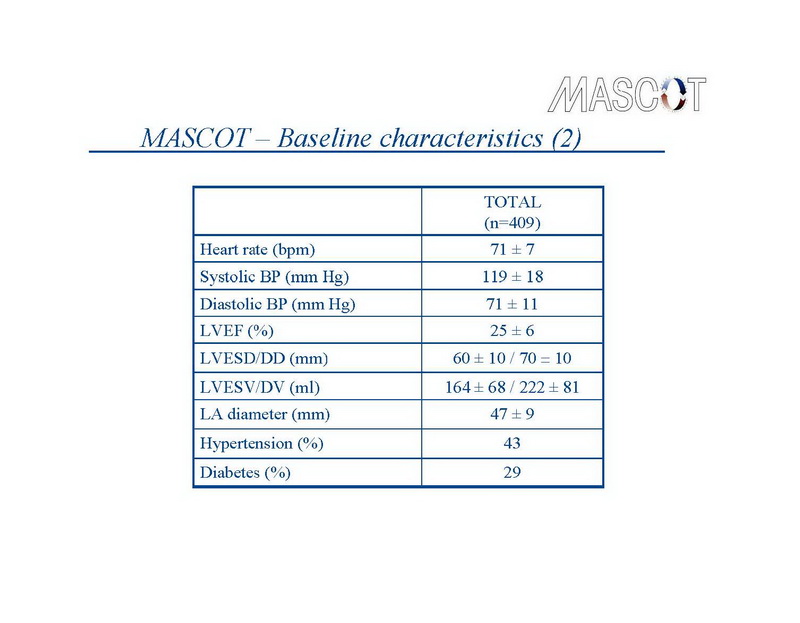
Entre setembro de 2003 e março de 2006, 409 pacientes foram incluídos no estudo MASCOT, em 34 centros médicos, em 10 países. A idade média foi de 68±10 anos, FEVE média de 25±6%, 203 pacientes (49.6%) tinham doença cardíaca isquêmica, 350 (85.6%) estavam em classe funcional III NYHA, e 78 pacientes (19%) tinham história de FA paroxística. Características basais da população do estudo são listadas nos slides 6,7,8,9. Mais de 90% dos pacientes eram tratados com um inibidor da enzima conversora de angiotensina ou bloqueador dos receptores de angiotensina, ou um diurético, ou ambos, 72% com bloqueador beta-adrenérgico e 29% com uma droga antiarrítmica.
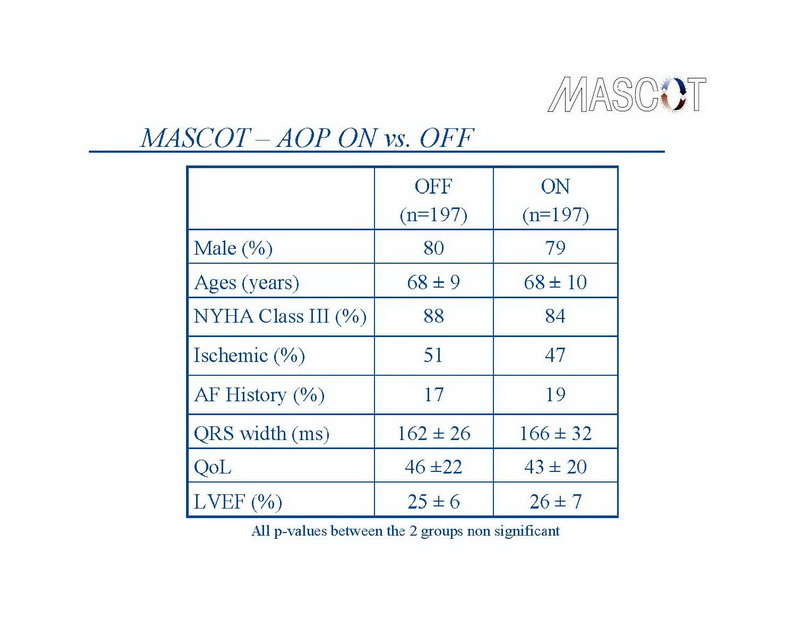
Os dispositivos de TRC foram implantados com sucesso em 394 pacientes. A escolha do dispositivo ficou a encargo dos investigadores. Os dispositivos TRC-D foram implantados em 228, e dispositivos TRC-P em 174 patients. O eletrodo atrial direito foi implantado em no apêndice atrial em 91% dos pacientes, 81% dos eletrodos no ventrículo direito foram implantados no ápice, e 69% dos eletrodos no ventrículo esquerdo foram implantados em um posição lateral ou póstero-lateral. Estes 394 pacientes foram randomizados para AOP desligado (grupo controle – n=197) e AOP Ligado (grupo tratamento – n=197). As características basais dos 2 grupos do estudo foram semelhantes. Em 1 ano, 323 pacientes permaneceram no estudo, dos quais, 148 pacientes no grupo controle e 156 no grupo tratamento, e compareceram nas consultas durante os 12 meses de seguimento. O fluxo de pacientes ao longo do estudo é mostrado no slide 10.
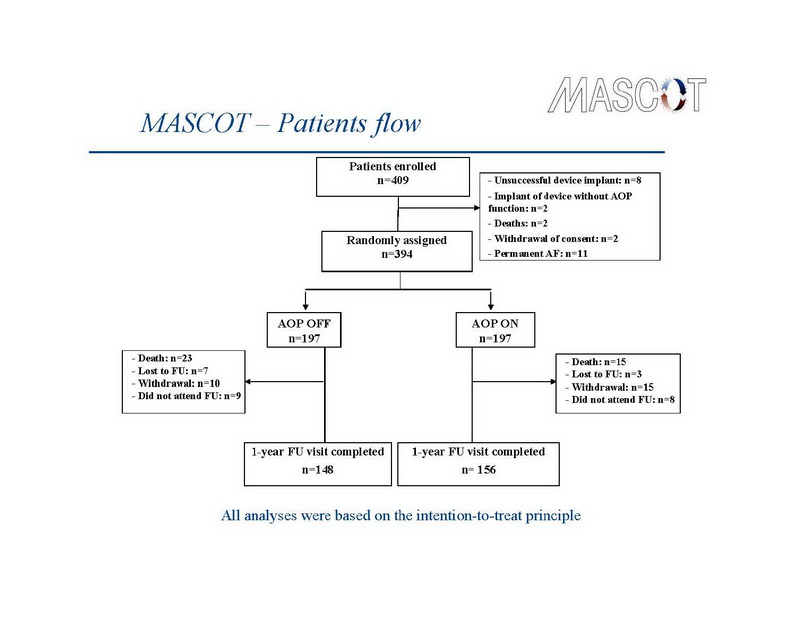
Resposta a terapia de ressincronização cardíaca
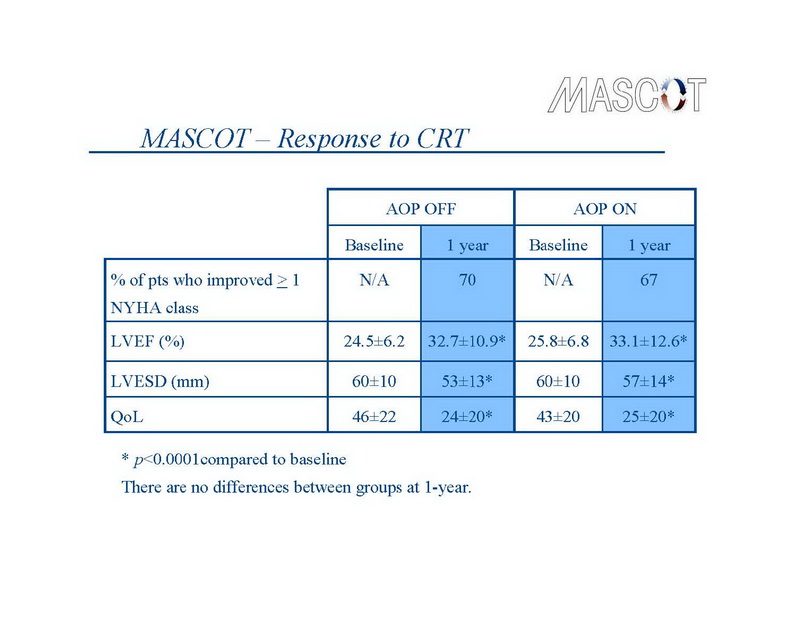
Em ambos os grupos do estudo, a TRC produziu mudanças consistentes com melhoras consideráveis na função cardíaca e suavização das manifestações da IC. (Slide 11) A classe NYHA diminuiu em ≥1 classe em 70% dos pacientes do grupo controle e em 67% dos pacientes do grupo tratamento. De maneira similar, o escore de Qualidade de Vida (QV) diminuiu (indicando uma melhora na QV) de 46±22 para 24±20 no grupo controle (P<0.0001) e de 43±20 para 25±20 no grupo tratamento (P<0.0001). O diâmetro sistólico final do VE diminuiu de 60±10 mm para 53±13 mm no grupo controle, e de 60±10 mm para 57±14 mm no grupo tratamento (ambos P<0.0001), enquanto aumentou a FEVE de 24.5±6.2 % para 32.7±10.9 % no grupo controle, e de 25.8±6.8% para 33.1±12.6 % no grupo tratamento (ambos P<0.0001). Em 1 ano, a diferença entre os grupos nestas variáveis não foram significantes.
Efeito da estimulação de supressão atrial “atrial overdrive pacing”(AOP)
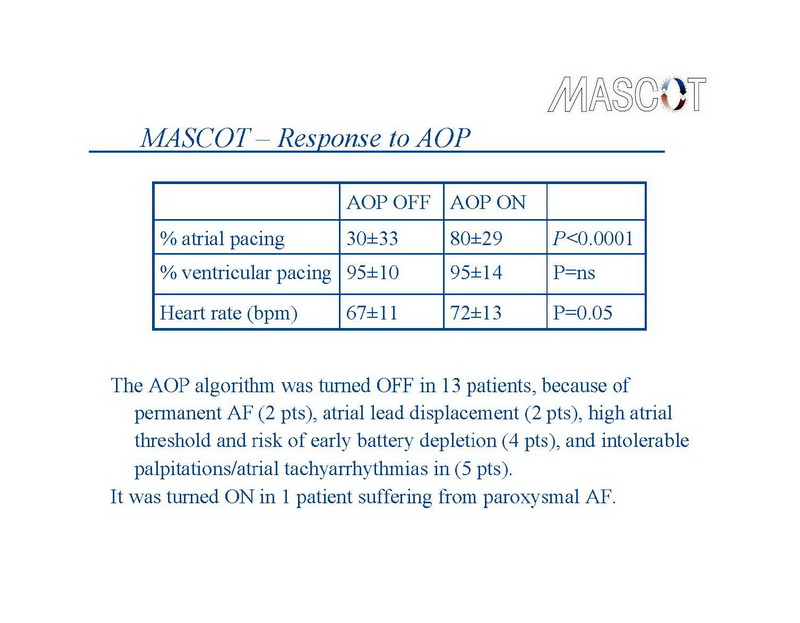
A percentagem média de estimulação atrial foi 80±29% no grupo tratamento, contra 30±33% no grupo controle (P<0.0001). As percentagens médias de estimulação ventricular foram respectivamente, 95±14% contra 95±10% (ns), como esperado em pacientes portadores de dispositivos de TRC. A frequência cardíaca média foi 67±11 bpm no grupo controle e 72±13 bpm no grupo tratamento (P=0.05) (Slide8). O algoritmo atrial de AOP estava desligado durante o seguimento em 13 pacientes, em 2 pacientes por causa de FA permanente, por deslocamento do eletrodo em 2, alto limiar atrial e risco de depleção precoce da bateria em 4, e palpitações intoleráveis/ taquiarritmia atrial em 5 pacientes. Em 1 paciente com FA paroxística foi reprogramado de OFF para ON.
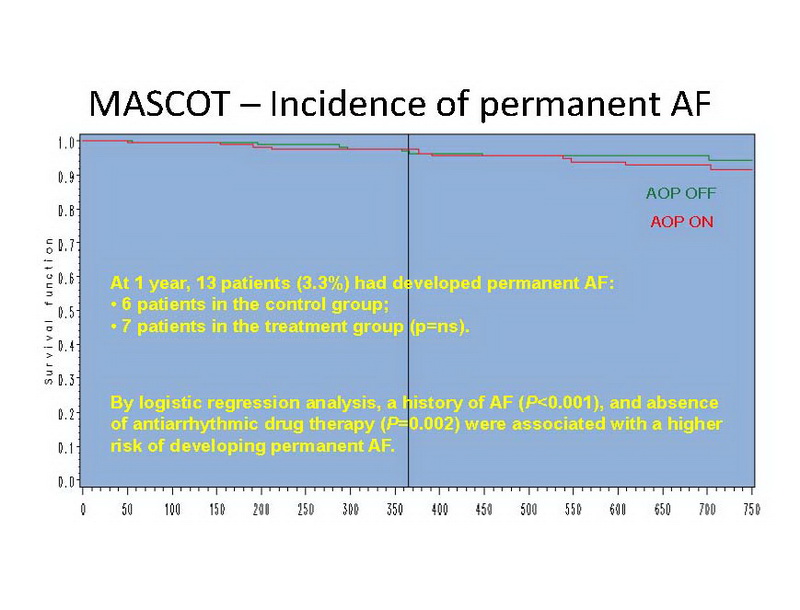
Em 1 ano, 13 pacientes (3,3%) desenvolveram FA permanente: 6 pacientes no grupo controle e 7 pacientes no grupo tratamento (ns) (slide 12).
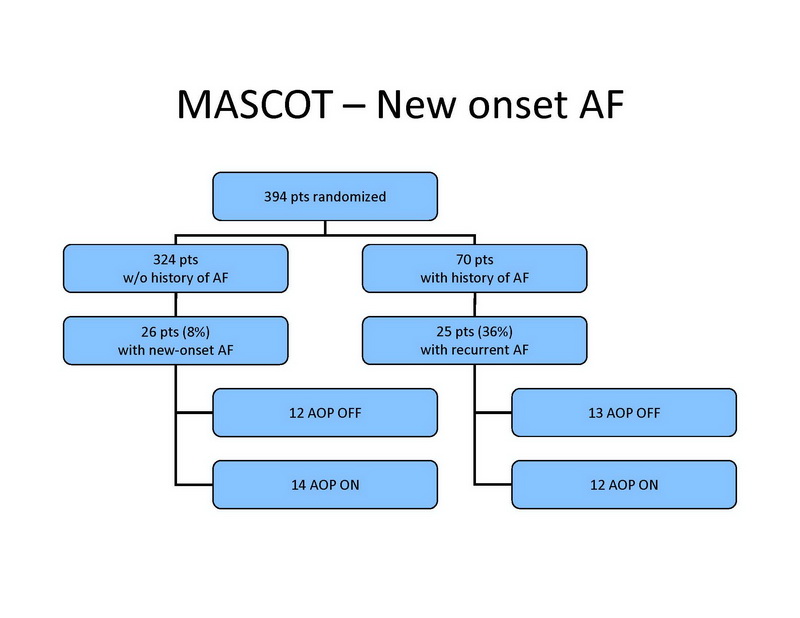
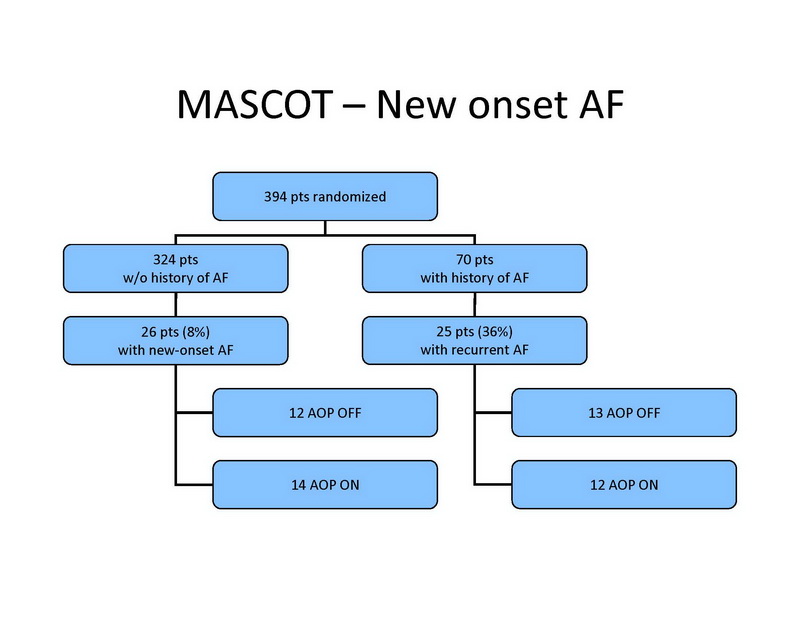
Entre os 324 pacientes sem história de FA, 26 (8%) desenvolveram FA de início recente, incluindo 20 pacientes com FA paroxística e 6 com FA permanente. FA de início recente foram desenvolvidas em 12 pacientes do grupo controle e em 14 pacientes do grupo tratamento (ns) (Slide 14). Entre os pacientes com história de FA no basal, 25 tiveram recorrências de FA durante o seguimento, e permanente em 7 pacientes. Fibrilação atrial recorrente foi documentada em 13 pacientes no grupo controle, e em 12 pacientes no grupo tratamento (ns).
Por meio da análise por regressão logística, a história de FA (P<0.001), e ausência de tratamento com drogas antiarrítmicas (P=0.002) foram associadas com alto risco de desenvolver FA permanente.
Morte durante o seguimento
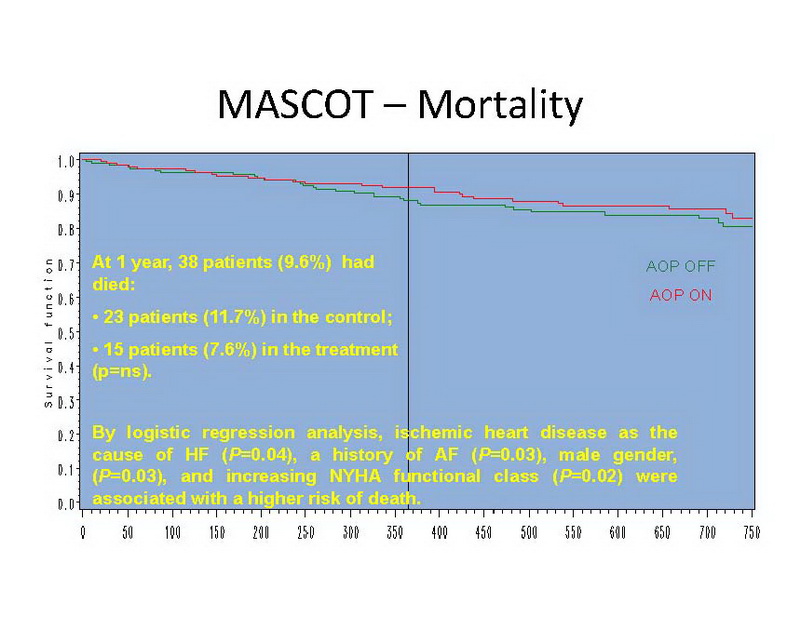
Durante o período de 1 ano de seguimento, 38 pacientes (9.6%) morreram, sendo 23 pacientes (11.7%) no grupo controle e 15 pacientes (7.6%) no grupo tratamento, sem diferença estatística significante (slide 15). As causas de morte foram: cardíaca em 23, não-cardíaca em 9 e de causas desconhecidas em 6 pacientes. Pela análise de regressão logística, doença cardíaca isquêmica como a causa de IC (P=0.04), história de FA (P=0.03), gênero masculino, (P=0.03), e aumento da classe funcional NYHA (P=0.02) foram associados com alto risco de morte.
Discussão
O estudo MASCOT é o primeiro estudo que avaliou prospectivamente a incidência de FA permanente e não-permanente, e o possível benefício preventivo concedido pela AOP, na população de portadores de TRC. Alguns poucos estudos restrospectivos11,19,20 e uma análise post hoc do estudo CARE-HF10 têm avaliado os efeitos da TRC no desenvolvimento de FA, enquanto a prevenção da FA em portadores de TRC não tem sido estudada. As características basais dos pacientes participantes do estudo MASCOT, similares a dos pacientes do estudo CARE-HF, representam os candidatos a TRC. Fung e colaboradores compararam a incidência de FA de início recente em pacientes tratados com TRC e em um grupo controle comparado durante um período de 3 anos.20 A incidência anual de FA de início recente, detectada durante as visitas hospitalares por avaliações clínicas, foi 2.8% em portadores de dispositivos de TRC, contra 10.2% no grupo controle, sugerindo um efeito preventivo da TRC contra FA. Huegl e colaboradores observaram uma diminuição do encargo da FA detectada pelos dispositivos diagnóticos, durante os primeiros 3 meses do implante do dispositivo, em um pequeno grupo de portadores de dispositivos de TRC.19 Neste estudo, a ocorrência de FA não foi relacionada a história prévia de FA, não interferindo com a resposta a TRC. Usando dispositivos diagnósticos, Adelstein e cols. compararam um grupo de pacientes submetidos a implantes mal-sucedidos de dispositivos de TRC, com portadores de dispositivos de TRC que responderam ou não a terapia de ressincronização.11 Durante 1 ano de seguimento, a diferença da incidência de FA não foi observada entre portadores de dispositivos de TRC e controles, nem em responsivos e não-responsivos a TRC.
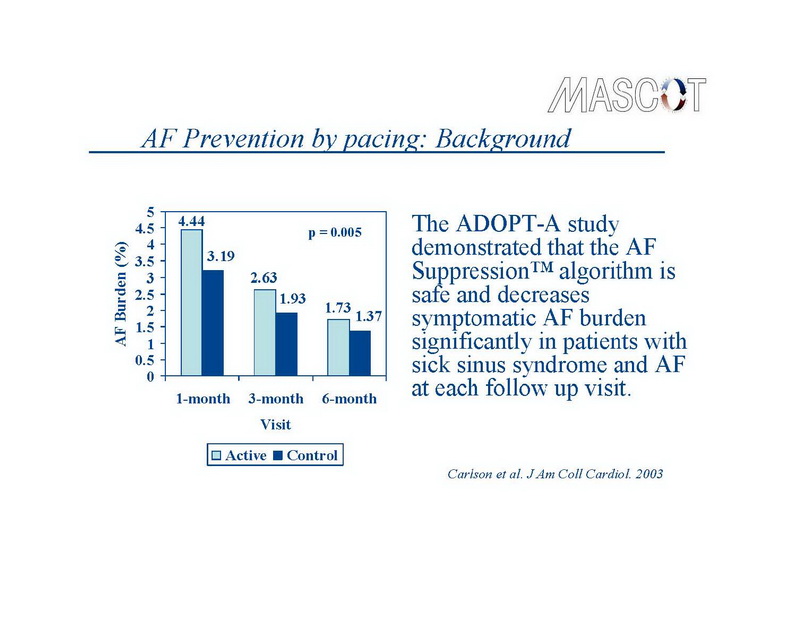
Em análise post hoc do estudo CARE-HF,10 a prevalência de FA no grupo TRC foi de 19% na entrada e FA de início recente desenvolveu em 16% ao longo dos 29 meses de seguimento. A TRC não afetou o desenvolvimento de FA, bem como o desenvolvimento de FA não afetou os efeitos terapêuticos da TRC. Em análise não publicada do estudo COMPANION, a prevelência de FA na admissão era 17% e a incidencia de FA de início recente foi de 16% ao longo de 15 meses.21 Neste estudo, quando comparado com terapia medicamentosa otima, TRC não reduziu a taxa de FA detectada durante avaliação clinica em visitas hospitalares. Finalmente, em estudo com 319 pacientes estimulados com historia de FA, Carlson et al. observaram redução de risco relativo de 25% na presença de FA com AOP se comparado com estimulação convencional.14
No MASCOT, baseado em revisao de prontuários, a prevalência de FA foi de 19% na admissão e 8% de incidência ao final de 1 ano de seguimento, e a incidência de FA permanente era de 3,3%. História de FA e ausência de antiarrítmicos no momento da inclusão no estudo foram associados ao desenvolvimento de FA permanente. A programação de AOP foi bem tolerada e aumentou a porcentagem de estimulação atrial significativamente, de 30% a 80%, ainda que aumentando a freqüência cardíaca apenas discretamente. Porém, em contraste com os efeitos em pacientes com doença do nó sinusal, 14 permitindo esta função neste estudo não teve efeito na redução de FA de início recente ou permanente. Nem AOP nem o desenvolvimento de FA de início recente ou permenente influenciaram a resposta a TRC.
Todos os estudos com TRC utilizaram sensor atrial (atrial tracking), estimulação biventricular (VDD), resultando na ausência de estimulacão atrial. Na prática, a maioria dos dispositivos são programados em DDD, resultando em estimulação atrial quando a frequência cardiaca intrínseca cai abaixo da zona de back-up programada. Isto permite otimização de drogas, incluindo a prescrição de beta-bloqueadores. 22,23 Neste estudo a porcentagem de estimulação atrial do grupo controle era de 30%. O efeito desta porcentagem de estimulação atrial no desnvolvimento de FA é desconhecido, e pode ter interferido com os resultados do estudo.
Os resultados de análise multivariada de mortalidade estão de acordo com as observações de Gasparini e cols.,32 que descobriram que IC secundária a cardiopatia isquêmica e classe funcional de NYHA IV foram preditores de mortalidade elevada. O possível impacto de história prévia de FA em mortalidade confirma a necessidade de maiores investigações dos pacientes que sofrem de IC em busca de FA.
Limitações do nosso estudo
A incidência de FA foi mensurada com base nas informações clínicas disponíveis durante as visitas hospitalares. A baixa incidência de FA permanente, que não permitiu a observação do desfecho primário do estudo, é uma outra importante limitação. Se esta baixa incidência de FA é resultante de um possível efeito benéfico da TRC é incerto.
Conclusões
Os resultados deste primeiro estudo sobre prevenção de FA em portadores de dispositivos de TRC, mostrou que AOP foi segura em pacientes com IC e função ventricular diminuida. Enquanto o algoritmo efetivamente aumentou o percentual de estimulação atrial de 30% para 80%, não diminuiu a incidência de FA permanente durante 1 ano de seguimento. Os pacientes serão acompanhados por mais um ano para confirmar estes resultados. (Slide 16)

Referências
1. Wang TJ, Larson MG, Levy D, Vasan RS, Leip EP, Wolf PA, D'Agostino RB, Murabito JM, Kannel WB, Benjamin EJ. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation. 2003; 107: 2920-5.
2. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol. 2003;91(6A):2D-8D.
3. Sanders P, Morton JB, Davidson NC, Spence SJ, Vohra JK, Sparks PB, Kalman JM. Electrical remodeling of the atria in congestive heart failure: electrophysiological and electroanatomic mapping in humans. Circulation. 2003; 108: 1461-8.
4. Swedberg K, Olsson LG, Charlesworth A, Cleland J, Hanrath P, Komajda M, Metra M, Torp-Pedersen C, Poole-Wilson P. Prognostic relevance of atrial fibrillation in patients with chronic heart failure on long-term treatment with beta-blockers: results from COMET. Eur Heart J. 2005; 26: 1303-8.
5. Baldasseroni S, De Biase L, Fresco C, Marchionni N, Marini M, Masotti G, Orsini G, Porcu M, Pozzar F, Scherillo M, Maggioni AP; Italian Network on Congestive Heart Failure. Cumulative effect of complete left bundle-branch block and chronic atrial fibrillation on 1-year mortality and hospitalization in patients with congestive heart failure. A report from the Italian network on congestive heart failure (in-CHF database). Eur Heart J. 2002; 23: 1692-8.
6. Cazeau S, Leclercq C, Lavergne T, Walker S, Varma C, Linde C, Garrigue S, Kappenberger L, Haywood GA, Santini M, Bailleul C, Daubert JC; Multisite Stimulation in Cardiomyopathies (MUSTIC) Study Investigators. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med. 2001; 344: 873-80.
7. Abraham WT, Fisher WG, Smith AL, Delurgio DB, Leon AR, Loh E, Kocovic DZ, Packer M, Clavell AL, Hayes DL, Ellestad M, Trupp RJ, Underwood J, Pickering F, Truex C, McAtee P, Messenger J; MIRACLE Study Group. Multicenter InSync Randomized Clinical Evaluation. Cardiac resynchronization in chronic heart failure. N Engl J Med. 2002; 346: 1845-53.
8. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, Carson P, DiCarlo L, DeMets D, White BG, DeVries DW, Feldman AM; Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med. 2004; 350: 2140-50.
9. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L; Cardiac Resynchronization-Heart Failure (CARE-HF) Study Investigators. The effect of cardiac resynchronization therapy on morbidity and mortality in heart failure (the CArdiac REsynchronization-Heart Failure [CARE-HF] Trial). N Engl J Med. 2005; 352: 1539-49.
10. Hoppe UC, Casares JM, Eiskjaer H, Hagemann A, Cleland JG, Freemantle N, Erdmann E. Effect of cardiac resynchronization on the incidence of atrial fibrillation in patients with severe heart failure. Circulation. 2006; 114: 18-25.
11. Adelstein EC, Saba S. Burden of atrial fibrillation after cardiac resynchronization therapy. Am J Cardiol. 2007; 100: 268-72.
12. Knight BP, Desai A, Coman J, Faddis M, Yong P. Long-term retention of cardiac resynchronization therapy. J Am Coll Cardiol. 2004; 44: 72-77.
13. Gasparini M, Auricchio A, Regoli F, Fantoni C, Kawabata M, Galimberti P, Pini D, Ceriotti C, Gronda E, Klersy C, Fratini S, Klein HH. Four-year efficacy of cardiac resynchronization therapy on exercise tolerance and disease progression: the importance of performing atrioventricular junction ablation in patients with atrial fibrillation. J Am Coll Cardiol. 2006; 48: 734-743.
14. Carlson MD, Ip J, Messenger J, Beau S, Kalbfleisch S, Gervais P, Cameron DA, Duran A, Val-Mejias J, Mackall J, Gold M; Atrial Dynamic Overdrive Pacing Trial (ADOPT) Investigators. A new pacemaker algorithm for the treatment of atrial fibrillation: results of the Atrial Dynamic Overdrive Pacing Trial (ADOPT). J Am Coll Cardiol. 2003; 42: 627-633.
15. Padeletti L, Purerfellner H, Adler SW, Waller TJ, Harvey M, Horvitz L, Holbrook R, Kempen K, Mugglin A, Hettrick DA; Worldwide ASPECT Investigators. Combined efficacy of atrial septal lead placement and atrial pacing algorithms for prevention of paroxysmal atrial tachyarrhythmia. J Cardiovasc Electrophysiol. 2003; 14: 1189-95.
16. Lee MA, Weachter R, Pollak S, Kremers MS, Naik AM, Silverman R, Tuzi J, Wang W, Johnson LJ, Euler DE; ATTEST Investigators. The effect of atrial pacing therapies on atrial tachyarrhythmia burden and frequency: results of a randomized trial in patients with bradycardia and atrial tachyarrhythmias. J Am Coll Cardiol. 2003; 41: 1926-32.
17. Padeletti L, Musilli N, Porciani MC, Colella A, Di Biase L, Ricciardi G, Pieragnoli P, Michelucci A, Gensini G. Atrial fibrillation and cardiac resynchronization therapy: the MASCOT study. Europace. 2004; 5 Suppl 1: S49-54.
18. Fuster V, Ryden LE, Asinger RW, Cannom DS, Crijns HJ, Frye RL, Halperin JL, Kay GN, Klein WW, Levy S, McNamara RL, Prystowsky EN, Wann LS, Wyse DG; American College of Cardiology; American Heart Association; European Society of Cardiology; North American Society of Pacing and Electrophysiology. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Eur Heart J. 2001; 22: 1852-923.
19. Huegl B, Bruns HJ, Unterberg-Buchwald C, Grosse A, Stegemann B, Lauer B, Geller JC, Gasparini M. Atrial fibrillation burden during the post-implant period after CRT using device-based diagnostics. J Cardiovasc Electrophysiol. 2006; 17: 813-817.
20. Fung JW, Yu CM, Chan JY, Chan HC, Yip GW, Zhang Q, Sanderson JE. Effects of cardiac resynchronization therapy on incidence of atrial fibrillation in patients with poor left ventricular systolic function. Am J Cardiol. 2005; 96: 728-31.
21. Saxon LA. Does cardiac resynchronization therapy reduce the incidence of atrial fibrillation, and does atrial fibrillation compromise the cardiac resynchronization therapy effect? Heart Rhythm. 2007; 4(3 Suppl): S31-33.
22. Stecker EC, Fendrick AM, Knight BP, Aaronson KD. Prophylactic pacemaker use to allow beta-blocker therapy in patients with chronic heart failure with bradycardia. Am Heart J. 2006; 151: 820-828
23. Aranda JM Jr, Woo GW, Schofield RS, Handberg EM, Hill JA, Curtis AB, Sears SF, Goff JS, Pauly DF, Conti JB. Management of heart failure after cardiac resynchronization therapy: integrating advanced heart failure treatment with optimal device function. J Am Coll Cardiol. 2005; 46: 2193-2198.
24. Ellenbogen KA. Pacing therapy for prevention of atrial fibrillation. Heart Rhythm. 2007; 4(3 Suppl): S84-87
25. Garrigue S, Barold SS, Cazeau S, Gencel L, Jais P, Haissaguerre M, Clementy J. Prevention of atrial arrhythmias during DDD pacing by atrial overdrive. Pacing Clin Electrophysiol. 1998; 21: 1751-9.
26. Yu CM, Fang F, Zhang Q, Yip GW, Li CM, Chan JY, Wu L, Fung JW. Improvement of atrial function and atrial reverse remodeling after cardiac resynchronization therapy for heart failure. J Am Coll Cardiol. 2007; 50: 778-85.
27. Vural A, Agacdiken A, Ural D, Sahin T, Kozdag G, Kahraman G, Ural E, Akbas H, Suzer K, Komsuoglu B. Effect of cardiac resynchronization therapy on left atrial appendage function and pulmonary venous flow pattern. Int J Cardiol. 2005; 102: 103-109.
28. Shinagawa K, Shi Y-F, Tardiff J-C, Leung T-K, Nattel S. Dynamic nature of atrial fibrillation substrate during development and reversal of heart failure in dogs. Circulation. 2002; 105: 2672-2678.
29. Hanna IR, Heeke B, Bush H, Brosius L, King-Hageman D, Dudley SC Jr, Beshai JF, Langberg JJ. Lipid-lowering drug use is associated with reduced prevalence of atrial fibrillation in patients with left ventricular systolic dysfunction. Heart Rhythm. 2006; 3: 881-886.
30. Healey JS, Baranchuk A, Crystal E, Morillo CA, Garfinkle M, Yusuf S, Connolly SJ.
Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol. 2005; 45: 1832-1839.
31. Noelker G, Marschang H, Gutleben K, Schibgilla V, Boileau P, Huemmer A,Hallier B, Brachmann J. Dynamic ventricular overdrive for rate regularization during atrial fibrillation. Europace. 2007; 9(Supp 3): 45. Abstract.
32. Gasparini M, Lunati M, Santini M, Tritto M, Curnis A, Bocchiardo M, Vincenti A, Pistis G, Valsecchi S, Denaro A; INSYNC/INSYNC ICD ITALIAN Registry Investigators.
Long-term survival in patients treated with cardiac resynchronization therapy: a 3-year follow-up study from the InSync/InSync ICD Italian Registry. Pacing Clin Electrophysiol. 2006; 29 Suppl 2: S2-10. |


