Lectures
Avaliação da dissincronia: outras técnicas
Foley, Paul / Leyva, Francisco
Introdução
De acordo com o paradigma vigente embasando TRC, dissincronia cardíaca contribui para insuficiência cardíaca (IC) e sua correção traz beneficio clínico. O primeiro atestado a este paradigma foi fornecido por Cazeau e cols., que em 1994 relatou dramática melhora em um homem tratado com estimulação das quatro câmaras. (1) Em estudo hemodinâmico Leclerq e cols. mostrou que ressincronização cardíaca temporária (TRC) usando estimulação biventricular levou a um aumento do débito cardíaco e redução da pressão encunhada de artéria pulmonar. (2) Relato de 27 pacientes com IC terminal, Auricchio e cols. mostraram um aumento da pressão de pulso aórtica e do dP/dt, que revertia no momento que a estimulação era interrompida. (3) O estudo MUSTIC (Multisite stimulation in Cardiomyopathies), estudo cego, cross over, de 67 pacientes mostrou que TRC reduziu dramaticamente o número de hospitalizações por IC e a classe funcional de NYHA, enquanto aumentou a qualidade de vida, distância percorrida e pico de captação de oxigênio no teste cardiopulmonar. (4) O maior estudo de desfechos sobre TRC, o CARE-HF, mostrou que esse tratamento levou a redução de 36% da mortalidade. (5) O estudo COMPANION mostrou que somar desfibrilador à TRC também gerou redução de mortalidade(6).
Vários mecanismos foram oferecidos até agora como possíveis explicações para os efeitos da TRC. A interação diastólica ventricular, demonstrável em pacientes com IC (7) é aliviada por estimulação biventricular e esquerda.(8) A TRC também reduz insuficiência mitral, tanto agudamente como a longo prazo. (9-11) A participação do fluxo sanguíneo, (12) etiologia da IC, (13) viabilidade miocárdica,(14) localização da cicatriz (15) e ritmo atrial(16,17) também foram exploradas. O mecanismo mais intuitivo pelo qual TRC confere beneficio é a redução da dissincronia. Enquanto ecocardiografia é o método mais utilizado para avaliar dissincronia, outros métodos estão emergindo. Esta revisão é focada em outros métodos que não ecocardiografia para avaliar dissincronia cardíaca.
Definição de resposta a TRC
Para que um teste seja significativo clinicamente, ele deve provar seu valor contra parâmetros clinicamente significativos, como sintomas, mortalidade e morbidade. Como mortalidade nem sempre é um parâmetro viável, exceto em desfechos de grandes estudos, parâmetros secundários, como remodelamento reverso de VE, se tornaram populares em estudos menores.
Para resumir o tema do que representa resposta a determinado tratamento, sintomas não são necessariamente marcadores de sobrevida. Em um extremo, a quimioterapia para tratamento de câncer é direcionado a beneficio de sobrevida, mas raramente leva a redução de sintomas. Por outro lado, tratamentos paliativos geralmente promovem alívio de sintomas, mas não aumento de sobrevida. O estudo CARE-HF sugere que todos os pacientes tratados com TRC melhoram em comparação com os tratados com terapia medicamentosa otimizada (TMO) apenas. (18) Ainda por outro lado, estudos discordam sobre o beneficio em termos de sintomas e medidas secundárias, como remodelamento reverso de VE. (19) É importante, então, qualificar se “taxa de resposta” está associado a sobrevida, sintomas ou ambos. Esta questão (definição de resposta) se aplica a maioria dos estudos.
Como limitação adicional, o termo “respondedor” não incorpora a medida do grau a partir do que um tratamento previne a deterioração, a menos que comparado com placebo. Após publicação das diretrizes, porém, a TRC não pode mais ser comparada com placebo. Por este motivo a taxa de resposta citada em estudos outros que não o CARE-HF e o COMPANION não reflete os efeitos de TRC na prevenção de deterioração clinica. Como seria esperado na historia natural da IC. Este é um fator a ser considerado em estudos de TRC.
Ecocardiografia
Estudos sobre TRC com ecocardiografia tendem a focar em desfechos secundários, sendo destes o mais popular o remodelamento reverso de VE. Vários grupos tem empregado medidas da dispersão do tempo-pico da velocidade da contração segmentar do miocárdio derivadas do Doppler tissular (TDI) como preditores de resposta a TRC.(20-23) Juntos, estes estudos demonstraram que dissincronia cardíaca prévia à TRC é necessária para obter beneficio da ressincronização.(24-25)
O estudo PROSPECT foi o primeiro multicêntrico a avaliar ecocardiografia como preditor de resposta a ressincronização. (26) Ainda que receios sobre a qualidade da aquisição dos dados e desenho do estudo tenham sido colocados (27) os autores da publicação original argumentaram que não existe medida ecocardiográfica única recomendada para seleção de pacientes para ressincronização. Baseado nisto, a sociedade americana de ecocardiografia recomenda que medidas ecocardiográficas de dissincronia não sejam usadas para recomendar TRC. (28) Exceto pelo United Kingdom National Institute of Clinical Excellence, nenhuma diretriz de nenhuma sociedade adotou ecocardiografia como método para seleção de pacientes para TRC.
O estudo PROSPECT a recapitulação do uso de ecocardiografia na seleção de pacientes para TRC. Em revisão recente Marwick chamou as numerosas medidas de dissincronia de Torre de Babel. (29) Nesta mesma revisão Marwick alude as limitações do TDI em medir dissincronia. Ele também cita a impraticabilidade de varias técnicas de quantificação de dissincronia. Vários grupos mostram ainda que mesmo pacientes controles podem apresentar dissincronia.(30-33) Outros mostram que alguns pacientes cm IC e QRS largo não satisfazem os critérios ecocardiograficos de disscincronia. (34) Enquanto ecocardiografistas se gabam de alta resolução temporal, isto na verdade pesa contra o método, já que aumenta o ruído. (35) Após uma década de pesquisa, não há consenso sobre o papel da ecocardiografia na quantificação de dissincronia para selecionar pacientes para TRC.
Medicina Nuclear
Cintilografia miocárdica permite medida de volumes ventriculares, perfusão miocárdica e contratilidade segmentar. Avaliando o valor prognóstico de dissincronia interventricular e intraventricular, Faucher e cols. estudaram 103 pacientes com miocardiopatia não isquêmica, 25% destes tinham BRE. (36) Analise fásica de Fourier do equilíbrio angiográfico do radionuclideo foi feita para ambos os ventrículos. (FIG 1) A diferenca entre a fase total dos ventrículo esquerdo e direito foi tomada como medida de dissincronia interventricular, enquanto desvios padrão entre as fases medias dentro de cada ventrículo foram tomadas como medida de dissincronia intraventricular. Os autores encontraram que ao longo de uma media de 27 meses, o desvio padrão da fase total do VE e VD (dissincronia intraventricular) foi preditor de eventos cardiovasculares. Entre 13 potenciais preditores de eventos em análise univariada, um desvio padrão elevado da fase média de VE (dissincronia intraventricular) e pressão encunhada de artéria pulmonar surgiram como preditores independentes de eventos cardíacos em análise multivariada.
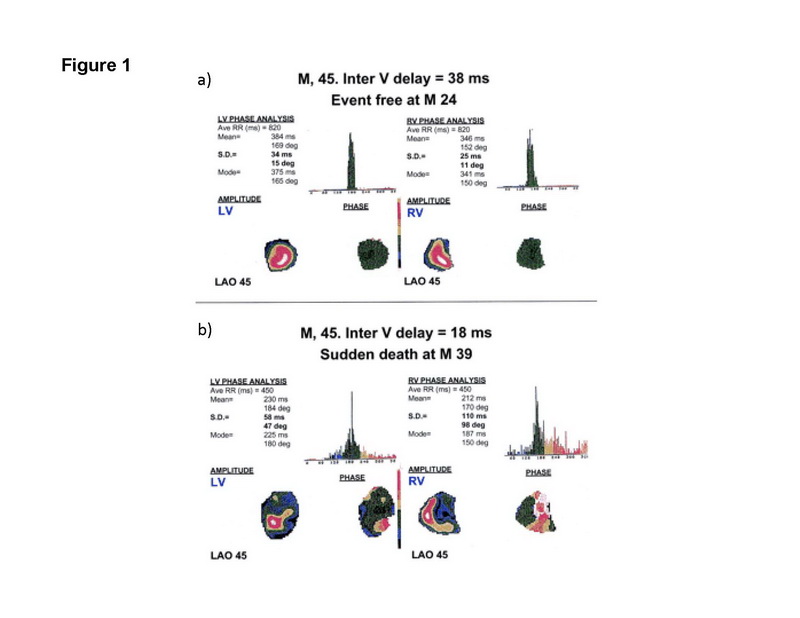
Figura 1: Análise fásica de ventriculografia por radionuclídeos. As imagens mostram o ventriculograma do VE e VD.(a) Mostra fase total de 384 ms para o VE e 346 ms para o VD, que faz uma diferença de 38ms; (b) Mostra fase total de 230 ms para VE e 212 ms para VD, com diferença total de 18 ms. Reproduzido com permissão de Fauchier e cols. (36)
Henneman e cols. usou análise fásica de perfusão por SPECT (tomografia computadorizada de fóton único) para avaliar dissincronia intraventricular. Quatro índices de dissincronia derivados da análise se correlacionaram bem com retardo septal-posterior no TDI. (37) Em outro estudo com 42 pacientes a serem submetidos a TRC, o mesmo grupo encontrou que desvio padrão e uma fase angulado a 42o no SPECT foi o melhor preditor de melhora de CF (> ou igual a 1) em 6 meses (curva da área sob o operador de 0,81). (38) Outros grupos notaram que medidas derivadas do SPECT de dissincronia mecânica tem pouca variação intra e inter observador. (39)
Além de fornecer medidas de dissincronia mecânica, o SPECT também avalia perfusão miocárdica e viabilidade, fatores que sabidamente influenciam resposta a TRC. (14, 15, 40, 41). Em estudo com 20 pacientes, Sciagra e cols. mostraram que em comparação com pacientes sem déficits de perfusão, pacientes com defeitos de perfusão afetando >50% do miocárdio no SPECT tem pior qualidade de vida e teste de caminhada de 6 minutos 3 meses após TRC. (42) Enquanto beneficio sintomático foi observado em pacientes com e sem defeitos de perfusão, aqueles com defeitos de perfusão não exibiram remodelamento reverso. Em estudo com 51 pacientes com IC secundaria a cardiopatia isquêmica, Ypenburg e cols. mostraram também uma relação entre resposta a TRC e extensão de miocárdio viável e cicatriz. Até 29 % dos pacientes com lesão transmural (< ou igual a 50% de atividade do marcador) na área do eletrodo de VE não mostraram melhora com TRC. (43) Em estudo retrospectivo com 51 pacientes, Aldestein e cols. mostrou que um escore de perfusão miocárdico baixo e cicatriz imediatamente adjacente ao eletrodo de VE eram mais prevalentes em pacientes não respondedores a TRC que em respondedores (resposta definida como aumento >15% na FEVE). (44)
Medicina Nuclear permite avaliação de pacientes com janelas ecocardiográficas ruins. Desvantagens, porém, incluem resolução espacial e temporal ruins e necessidade do uso de radiação.
Tomografia Computadorizada
Ventriculografia contrastada usando tomografia permite delineamento adequado dos limites do miocardio ao longo do ciclo cardíaco, fazendo dela um método de imagem potencial para avaliação de dissincronia. Truonge e cols. estudou 38 pacientes candidatos a TRC usando TC multislice-64 colimadores. (45) Limites endocárdico e epicárdico foram localizados ao longo do ciclo cardíaco, com cada ciclo dividido em 10 fases. O índice de dissincronia foi definido como desvio padrão do tempo de espessamento máximo para cada segmento do miocárdio. O índice de dissincronia médio foi de 152 ± 44 ms em pacientes com IC e QRS largo e de 65 ± 12 ms em pacientes controle. Os autores encontraram excelente concordância entre dois observadores independentes. Ainda que o índice de 65 ± 12 ms não tenha sido avaliado contra desfechos de TRC uma boa correlação com Ecocardiografia “Speckle tracking”. (45)
Ressonância Magnética Cardíaca
Ressonância magnética cardíaca (RMC) ganhou espaço como o padrão ouro em quantificar volumes ventriculares. Recentemente RMC tem sido aplicada para avaliação de dissincronia. Assim como com outros métodos de imagem, dissincronia pode ser medida em termos de dispersão temporal da contratilidade segmentar. Chiali e cols. recentemente usou desvio padrão do tempo entre o pico da contratilidade entre os diversos segmentos miocárdicos como medida de dissincronia. (fig 2) (46) Comparado com medidas de TDI, o índice de sincronia tecidual pela RMC (CMR-TSI) emerge como um bom discriminador entre controles saudáveis e pacientes com IC. (Fig 3) Mais que isso, CMR-TSI é um potente marcador independente de mortalidade e morbidade após TRC: pacientes com CMR-TSI > ou igual a 110ms foram 3.8 vezes mais propensos a morrer que os com CMR-TSI menor que 110 ms. Estes dados dão suporte ao uso de RMC na estratificação de risco de pacientes que serão submetidos à TRC.
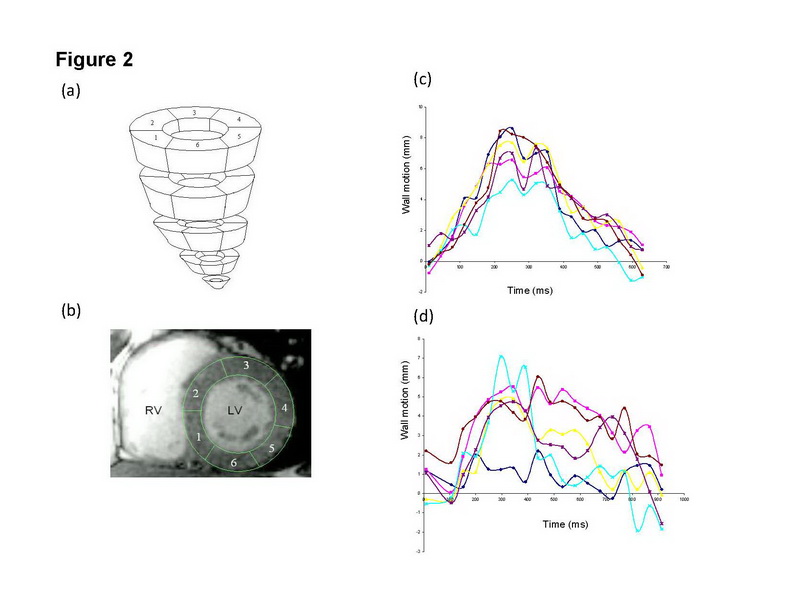
Figura 2: Acessando dissincronia usando contratilidade segmentar pela RMC. (a) mostra cortes do VE da base (acima) para o ápice (abaixo), cada corte com 6 segmentos; (b) mostra o VE em eixo curto, com contorno manual do epicárdio e endocárdio; (c) mostra contratilidade segmentar versus tempo em controle saudável; (d) mostra contratilidade segmentar versus tempo em paciente com IC e bloqueio de ramo esquerdo. Reproduzido com permissão de Chalil e cols. (46)
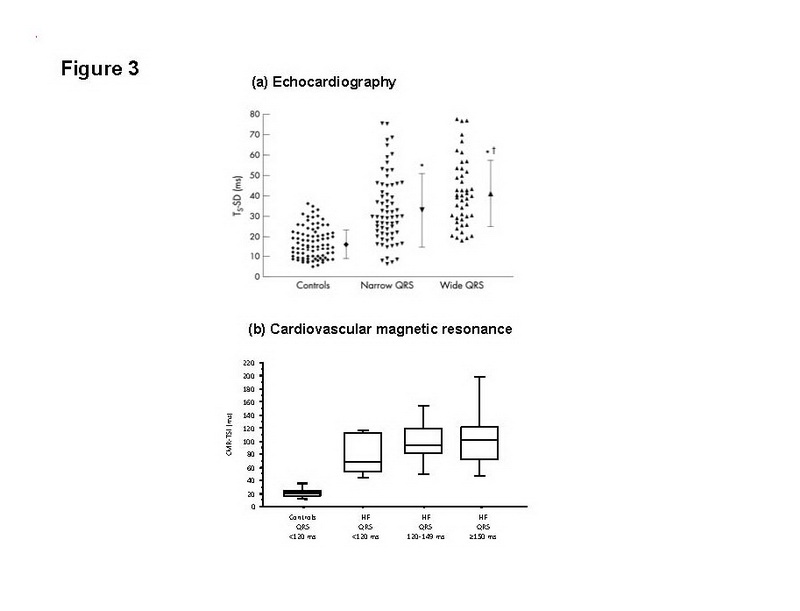
Figura 3: Acessando dissincronia em IC VS controles. (a) Desvio padrão da velocidade QRS-pico em 12 segmentos miocárdicos derivado de TDI em pacientes saudáveis e em pacientes com IC, com QRS menor que 120 ms e maior ou igual a 120 ms. [com permissão de Yu CM E COLS.(23)]; (b) Desvio padrão do tempo ate o pico da movimentação sistólica da parede(CMR-TSI) em controles e pacientes com IC com varias durações de QRS. (com permissão de CHalil e cols. (46). Note a falta de sobreposição na CMR_TSI entre saudáveis e IC.
Outros métodos de avaliação de dissincronia cardíaca pela RMC surgiram. “Myocardial Tagging” ou uso de marcadores de miocárdio é outro método padrão ouro para avaliar contratilidade segmentar e estresse de parede em cortes longitudinais, circunferenciais e radiais. (47,48) (Fig4) RMC guiada por estresse (Strain –coded CMR) fornece medida em tempo real do estresse parietal que é aplicável ao rápido acesso de dissincronia de VE. (47) Helm e cols. recentemente desenvolveram um método para avaliar dissincronia usando RMC tridimensional. (49) RMC guiada por velocidade tem ótima correlação com TDI. (50) Ainda que experimentalmente útil, estas técnicas não foram validadas contra desfecho clinico de TRC, e portanto ainda não tem aplicações praticas.

Figura 4: Exemplo de RMC com marcadores sobrepostos em eixo curto de VE. Os marcadores lineares (baixo sinal) marcam áreas de miocárdio ao longo do ciclo cardíaco. As linhas parecem “esticadas” durante sístole. Acompanhamento de miocárdio marcado (“tagged”) usando software especial permite avaliação da contratilidade no eixo longitudinal, circunferencial e radial
Mapeamento endocárdico
Na sua forma mais simples, ECG de 12 derivações fornece uma grosseira medida de dissincronia elétrica. A distribuição da ativação do endocárdio, porém, é melhor avaliada por métodos invasivos, como o mapeamento endocárdico. Usando esta técnica, o grupo de Auricchio provou que em corações normais os pontos de ativação mais tardia são a parede postero-lateral e postero-basal. (51) Em pacientes com IC e BRE ativação ventricular segue uma forma de U, dando a volta ao redor do ápice e parede inferior para chegar na parede posterolateral. (51) O padrão de ativação ventricular no BRE é extremamente variável, (52), mas a resposta a TRC parece maior em pacientes com evidencia de distúrbio de condução, em comparação com os com ativação ventricular homogênea. (53)
Identificando a zona de ativação mais tardia, mapeamento eletroanatômico sem contato (non-contact mapping) também permite direcionar o melhor lugar para posicionar o eletrodo de VE. (54) Lambiase e cols. estudaram 10 pacientes com IC através de mapeamento. (55) Eles formularam a hipótese de que os não respondedores seriam aqueles estimulados em áreas com condução lenta, enquanto colocação do eletrodo em área de condução normal resulta em resposta hemodinâmica adequada. Neste estudo agudo, pacientes foram submetidos a mapeamento sem contato em ritmo sinusal e estimulação. Um catéter foi posicionado em VE para estimular o VE durante estimulação biventricular. Em pacientes com cardiopatia isquêmica, zona de condução lenta foi encontrada ao redor do seio coronário, com velocidade 73% menor que na parede lateral. Estimulando a área de ativação normal ao contrario de zona de condução lenta resultou em aumento de 22% na dP/dt, que representou aumento de 15% no débito cardíaco. Este estudo demonstrou como non-contact mapping (mapeamento eletroanatomico sem contato) pode ser usado para localizar o melhor local de implante de eletrodo de VE. A limitação desse método é que o eletrodo geralmente é posicionado no epicárdio. Não se sabe ao certo se os achados do mapeamento do endocárdio podem se correlacionar ao epicárdio.
Conclusões
Ecocardiografia é o método mais usado para avaliar dissincronia mecânica. Ainda que vários métodos de avaliação de dissincronia foram preditores de desfechos relacionados a TRC em estudos de centro único, eles foram de limitada aplicação em estudos multicêntricos. Mais refinamento nas técnicas ecocardiográficas e suas aplicações a seleção de candidatos a TRC são necessárias. Outras técnicas de imagem como RMC, medicina nuclear, tomografia computadorizada tem potencial no papel de selecionar os candidatos para esse tratamento. Sozinhos ou combinados com mapeamento eletroanatômico, estas técnicas podem ser usadas para selecionar pacientes ideais para TRC, bem como posicionar o eletrodo de VE. Avaliação adequada destas modalidades contra desfechos clinicamente significativos ainda são necessários antes da introdução destes na pratica clinica.
REFERÊNCIAS
1. Cazeau S, Ritter P, Bakdach S, et al. Four chamber pacing in dilated cardiomyopathy. Pacing Clin Electrophysiol 1994;17:1974-1979.
2. Leclercq C, Cazeau S, Le Breton H, et al. Acute hemodynamic effects of biventricular DDD pacing in patients with end stage heart failure. J Am Coll Cardiol 1998;32:1825-1831.
3. Auricchio A, Stellbrink C, Block M, et al. Effect of Pacing Chamber and Atrioventricular Delay on Acute Systolic Function of Paced Patients with Congestive Heart Failure. Circulation 1999;99:2993-3001.
4. Cazeau S, Leclercq C, Lavergne T, et al. The Multisite Stimulation in Cardiomyopathies Study I. Effects of Multisite Biventricular Pacing in Patients with Heart Failure and Intraventricular Conduction Delay. N Engl J Med 2001;344:873-880.
5. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L, on behalf of the CArdiac Recynchronization in Heart Failure (CARE-HF) Investigators. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352:1539-1549.
6. Bristow MR, Saxon LA, Borehmer J, et al. for the Comparison of Medical Therapy, Pacing and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac resynchronization therapy with or without an implantable defibrillator in advanced heart failure. N Eng J Med 2004;350:2140-2150.
7. Atherton JJ, Moore TD, Lele SS, et al. Diastolic ventricular interaction in chronic heart failure. The Lancet 1997;349:1720-1724.
8. Bleasdale RA, Turner MS, Mumford CE, et al. Left ventricular pacing minimizes diastolic ventricular interaction, allowing improved preload-dependent systolic performance. Circulation 2004;110:2395-2400.
9. Ypenburg C, Lancellotti P, Tops LF, Bleeker GB, et al. Acute Effects of Initiation and Withdrawal of Cardiac Resynchronization Therapy on Papillary Muscle Dyssynchrony and Mitral Regurgitation. J Am Coll Cardiol 2007;50:2071-2077.
10. Nunez A, Alberca MT, Francisco G, et al. Severe mitral regurgitation with right ventricular pacing, successfully treated with left ventricular pacing. Pacing Clin Electrophysiol 2002; 25:226-230.
11. Roba M, Anguera I, Champagne J, et al. Left ventricular pacing reduces systolic mitral regurgitation and improves mitral valve closure in heart failure patients with markedly prolonged QRS. Eur Heart J 2000;21:119.
12. Lindner O, Vogt J, Kammeier A, et al. Effect of cardiac resynchronization therapy on global and regional oxygen consumption and myocardial blood flow in patients with non-ischaemic and ischaemic cardiomyopathy. Eur Heart J 2005; 26:70-76.
13. Wikstrom G, Lundqvist CB, Andren B, et al, on behalf of the CARE-HF Investigators. The effects of aetiology on outcome in patients treated with cardiac resynchronization therapy in the CARE-HF trial. Eur Heart J 2009;Epub ahead of print.
14. Chalil S, Foley PWX, Muyhaldeen SA, et al. Late gadolinium enhancement-cardiovascular magnetic resonance as a predictor of response to cardiac resynchronization therapy in patients with ischaemic cardiomyopathy. Europace 2007; 9:1031-1037.
15. Chalil S, Stegemann B, Muhyaldeen S, Khadjooi K, Foley PWX, Smith REA, Leyva F. Effect of posterolateral left ventricular scar on mortality and morbidity following cardiac resynchronization therapy. Pacing Clin Electrophysiol 2007;30:1-9.
16. Khadjooi K, Foley P, Anthony J, Chalil S, Smith R, Frenneaux M, Leyva F. Long-term effects of cardiac resynchronisation therapy in patients with atrial fibrillation. Heart 2008;94:879-883.
17. Gasparini M, Auricchio A, Metra M, et al.on behalf of the Multicentre Longitudinal Observational Study (MILOS) Group. Long-term survival in patients undergoing cardiac resynchronization therapy: the importance of atrio-ventricular junction ablation in patients with permanent atrial fibrillation. Eur Heart J 2008;29:1644-1652.
18. Cleland JGF, Cullington D, Khaleva O, Tageldien A. Cardiac resynchronization therapy: dyssynchrony imaging from a heart failure perspective. Curr Opin Cardiol 2008; 23:634-645.
19. Yu CM, Bleeker GB, Fung JW, et al. Left ventricular reverse remodeling but not clinical improvement predicts long-term survival after cardiac resynchronization therapy. Circulation 2005; 112:1580-1586.
20. Yu CM, Fung WH, Lin H, Zhang Q, Sanderson JE, Lau CP. Predictors of left ventricular reverse remodeling after cardiac resynchronization therapy for heart failure secondary to idiopathic dilated or ischemic cardiomyopathy. Am J Cardiol 2003; 91:684-688.
21. Bax JJ, Marwick TH, Molhoek SG, et al. Left ventricular dyssynchrony predicts benefit of cardiac resynchronization therapy in patients with end-stage heart failure before pacemaker implantation. Am J Cardiol 2003; 92:1238-1240.
22. Yu CM, Chan YS, Zhang Q, et al. Benefits of cardiac resynchronization therapy for heart failure patients with narrow QRS complexes and coexisting systolic asynchrony by echocardiography. J Am Coll Cardiol 2006; 48:2251-2257.
23. Yu CM, Lin H, Zhang Q, Sanderson JE. High prevalence of left ventricular systolic and diastolic asynchrony in patients with congestive heart failure and normal QRS duration. Heart 2003; 89:54-60.
24. Bax JJ, Abraham T, Barold SS, et al. Cardiac Resynchronization Therapy: Part 1--Issues Before Device Implantation. J Am Coll Cardiol 2005;46:2153-2167.
25. Bax JJ, Bleeker GB, Marwick TH, et al. Left ventricular dyssynchrony predicts response and prognosis after cardiac resynchronization therapy. J Am Coll Cardiol 2004; 44:1834-1840.
26. Chung ES, Leon AR, Tavazzi L, et al. Results of the Predictors of Response to CRT (PROSPECT) Trial. Circulation 2008;117:2608-2616.
27. Yu CM, Bax JJ, Gorcsan III J. Critical appraisal of methods to assess mechanical dyssynchrony. Curr Opin Cardiol 2009;24:18-28.
28. Gorcsan III J, Abraham T, Agler DA, et al. Echocardiography for Cardiac Resynchronization Therapy: Recommendations for Performance and Reporting-A Report from the American Society of Echocardiography Dyssynchrony Writing Group Endorsed by the Heart Rhythm Society. J Am Soc Echocardiogr 2008; 21:191-213.
29. Marwick TH. Hype and Hope in the Use of Echocardiography for Selection for Cardiac Resynchronization Therapy: The Tower of Babel Revisited. Circulation 2008; 117:2573-2576.
30. Miyazaki C, Powell BD, Bruce CJ, et al. Comparison of Echocardiographic Dyssynchrony Assessment by Tissue Velocity and Strain Imaging in Subjects With or Without Systolic Dysfunction and With or Without Left Bundle-Branch Block. Circulation 2008; 117:2617-2625.
31. Van Bommel RJ, Delgado V, Ypenburg C, et al. Left Ventricular Dyssynchrony Measured by Speckle-Tracking Radial Strain Analysis Predicts Survival After Resynchronization Therapy. Circulation 2008;118:S8678 (abstract).
32. Soliman OII, Theuns DAMJ, Geleijnse ML, et al. Spectral pulsed-wave tissue Doppler imaging lateral-to-septal delay fails to predict clinical or echocardiographic outcome after cardiac resynchronization therapy. Europace 2007;9:113-118.
33. Conca C, Faletra FF, Miyazaki C, et al. Echocardiographic Parameters of Mechanical Synchrony in Healthy Individuals. Am J Cardiol 2009;103:136-142.
34. De Boeck BWL, Meine M, Leenders GE, et al. Practical and conceptual limitations of tissue Doppler imaging to predict reverse remodelling in cardiac resynchronisation therapy. Eur J Heart Fail 2008;10:281-290.
35. Marwick TH. Measurement of Strain and Strain Rate by Echocardiography: Ready for Prime Time?. J Am Coll Cardiol 2006;47:1313-1327.
36. Fauchier L, Marie O, Casset-Senon D, et al. Interventricular and intraventricular dyssynchrony in idiopathic dilated cardiomyopathy. A prognostic study with Fourier phase analysis of radionuclide angioscintigraphy. J Am Coll Cardiol 2002;40:2022-2030.
37. Henneman MM, Chen J, Ypenburg C, et al. Phase Analysis of Gated Myocardial Perfusion Single-Photon Emission Computed Tomography Compared With Tissue Doppler Imaging for the Assessment of Left Ventricular Dyssynchrony. J Am Coll Cardiol 2007; 49:1708-1714.
38. Henneman MM, Chen J, Dibbets-Schneider P, et al. Dyssynchrony as Assessed with Phase Analysis on Gated Myocardial Perfusion SPECT Predict Response to CRT?. J Nucl Med 2007; 48:1104-1111.
39. Trimble MA, Borges-Neto S, Honeycutt EF, et al. Evaluation of mechanical dyssynchrony and myocardial perfusion using phase analysis of gated SPECT imaging in patients with left ventricular dysfunction. J Nucl Cardiol 2008;15:663-670.
40. Bleeker GB, Kaandorp TAM, Lamb HJ, et al. Effect of posterolateral scar tissue on clinical and echocardiographic improvement after cardiac resynchronization therapy. Circulation 2006;113:969-976
41. White JA, Yee R, Yuan X, et al. Delayed enhancement magnetic resonance imaging predicts response to cardiac resynchronization therapy in patients with intraventricular dyssynchrony. J Am Coll Cardiol 2006;48:1953-1960.
42. Sciagra R, Giaccardi M, Porciani MC, et al. Myocardial perfusion imaging using gated SPECT in heart failure patients undergoing cardiac resynchronization therapy. J Nucl Med 2004;45:164-168.
43. Ypenburg C, Schalij MJ, Bleeker GB, et al. Impact of viability and scar tissue on response to cardiac resynchronization therapy in ischaemic heart failure patients. Eur Heart J 2007;28:33-41.
44. Adelstein EC, Saba S. Scar burden by myocardial perfusion imaging predicts echocardiographic response to cardiac resynchronization therapy in ischemic cardiomyopathy. Am Heart J 2007;153:105-112.
45. Truong QA, Singh JP, Cannon CP, et al. Quantitative Analysis of Intraventricular Dyssynchrony Using Wall Thickness by Multidetector Computed Tomography. J Am Coll Cardiol Img 2008; 1:772-781.
46. Chalil S, Stegemann B, Muhyaldeen S, et al. Intraventricular Dyssynchrony Predicts Mortality and Morbidity After Cardiac Resynchronization Therapy: A Study Using Cardiovascular Magnetic Resonance Tissue Synchronization Imaging. J Am Coll Cardiol 2007;50:243-252.
47. Lardo AC, Abraham TP, Kass DA. Magnetic Resonance Imaging Assessment of Ventricular Dyssynchrony: Current and Emerging Concepts. J Am Coll Cardiol 2005;46:2223-2228.
48. Wyman BT, Hunter WC, Prinzen FW, et al. Mapping propagation of mechanical activation in the paced heart with MRI tagging. Am J Physiol 1999;276:H881-H891.
49. Helm RH, Lecquercq C, Faris Q, et al. Cardiac dyssynchrony analysis using circumferential versus longitudinal strain: Implications for assessing cardiac resynchronization. Circulation 2005;111:2760-2767.
50. Westenberg JJM, Lamb H, van der Geest RJ, et al. Assessment of left ventricular dyssynchrony in patients with conduction delay and idiopathic dilated cardiomyopathy. J Am Col Cardiol 2006;47:2042-2048.
51. Auricchio A, Fantoni C, Regoli F, et al. Characterization of left ventricular activation in patients with heart failure and left bundle-branch block. Circulation 2004;109:1133-1139.
52. Fung JWH, Yu CM, Yip G, et al. Variable left ventricular activation pattern in patients with heart failure and left bundle branch block. Heart 2004;90:17-19.
53. Fung JWH, Chan JYS, Yip GWK, et al. Effect of left ventricular endocardial activation pattern on echocardiographic and clinical response to cardiac resynchronization therapy. Heart 2007;93:432-437.
54. Schilling RJ. Non-contact mapping of the left ventricle and new insights into the mechanisms for success of biventricular pacing. Heart 2004;90:3-4.
55. Lambiase PD, Rinaldi A, Hauck J, et al. Non-contact left ventricular endocardial mapping in cardiac resynchronisation therapy. Heart 2004;90:44-51.
|


