Lectures
Fibrilación auricular en pacientes que recibieron un dispositivo de Terapia de Resincronización Cardíaca
Padeletti , Luigi
Resumen
Antecedentes: La fibrilación auricular (FA) se asocia con una morbilidad y mortalidad aumentada en los pacientes que sufren insuficiencia cardíaca (IC). Los pacientes en clases NYHA (New York Heart Association) III o IV, con disfunción sistólica y un QRS ancho, son candidatos para la terapia de resincronización cardíaca (TRC) y pueden beneficiarse con la sobreestimulación auricular.
Métodos: El ensayo MASCOT reclutó 409 pacientes que habían recibido un dispositivo de TRC (79% hombres), que fueron asignados al azar a sobreestimulación auricular (n=197) vs. sin sobreestimulación (n=197) y seguidos por 1 año. Su edad promedio fue 68±10 años, fracción de eyección del ventrículo izquierdo (FEVI) 25±6%, duración QRS 163±29 ms. La clase III de NYHA estuvo presente en el 86% de los pacientes, y un 19% tenía historia de FA paroxística. El objetivo primario del estudio fue la incidencia de FA permanente a 1 año.
Resultados: La sobreestimulación auricular aumentó el porcentaje de estimulación auricular de 30 a 80% (P<0,0001), se toleró bien y no interfirió con a) la aplicación de la TRC (95% de la estimulación ventricular promedio en ambos grupos), b) la respuesta a la TRC (70% de pacientes respondieron en el grupo de control, versus 67% en el grupo de tratamiento), o c) la función cardíaca (la FEVI aumentó de 24,5±6,2% a 32,7±10,9% en el grupo de control, y de 25,8±6,8% a 33,1±2,6% en el grupo de tratamiento). La incidencia de la FA permanente fue 3,3% en ambos grupos. Por análisis de regresión logística, una historia de FA (P<0,001), y la ausencia de drogas antiarrítmicas (P=0,002) se asociaron con FA permanente.
Conclusiones: En este primer ensayo de un algoritmo específico de prevención de la FA en pacientes que reciben TRC, la sobreestimulación fue segura y no agravó la IC. El algoritmo de prevención no disminuyó la incidencia de FA a 1 año.
Palabras clave: Terapia de resincronización cardíaca – estimulación biventricular – estimulación multisitio – insuficiencia cardíaca – fibrilación auricular.
Introducción
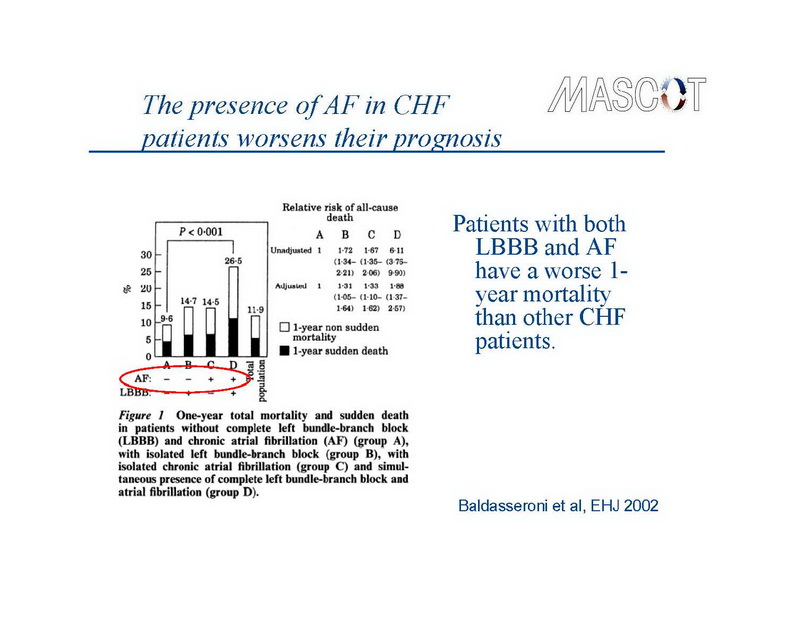
La fibrilación auricular (FA), la arritmia sostenida más común, y la insuficiencia cardíaca (IC), una de las principales causas de morbilidad y mortalidad en los países desarrollados, comparten varios factores de riesgo y con frecuencia coexisten en el mismo paciente (1,2). La prevalencia de ambos trastornos, cada uno independientemente la causa de considerable morbilidad y mortalidad, está en aumento. Además, cada uno de ellos parece predisponer directamente al otro. Específicamente, la IC promueve el remodelado auricular, y facilita el desarrollo de la FA (3), mientras que los pacientes que desarrollan FA durante la IC, sufren una mayor morbilidad y mortalidad que los pacientes que permanecen en ritmo sinusal (1,4), especialmente en la presencia de bloqueo de rama izquierda (5) (Diapositivas 1,2,3).
La terapia de resincronización cardíaca (TRC) alivia los síntomas, disminuye la necesidad de internaciones, y mejora la función cardíaca y la sobrevida en pacientes que sufren IC de moderada a severa por disfunción sistólica asociada a disincronía eléctrica (6-9). En algunos pocos estudios, la TRC por sí sola no disminuyó la incidencia de FA (10,11), mientras que los episodios de FA resultaron en a) pérdida de resincronización o entrega de terapia subóptima (12,13) b) menor remodelado inverso, y c) menor mejora de la capacidad funcional. Los algoritmos de estimulación dedicados se han diseñado para evitar la FA al sobreestimular continuamente la aurícula derecha a una frecuencia superior a la frecuencia cardíaca intrínseca. (Diapositiva 4).
Estos algoritmos se han probado en varias poblaciones de pacientes estimulados con resultados variados (14-16), aunque no específicamente en candidatos a TRC.
El ensayo MASCOT se diseñó para examinar si agregar la sobreestimulación auricular a la estimulación biventricular tendría un efecto sobre la incidencia de FA permanente al compararse con la estimulación biventricular por sí sola (17).
Métodos
Diseño del estudio
Este estudio multicéntrico, simple ciego, randomizado y paralelo, comparó la seguridad y la eficacia de un algoritmo específico de sobreestimulación auricular (AF Suppression™, St Jude Medical, Sylmar, CA) en los pacientes que recibían TRC. El protocolo de estudio fue revisado y aprobado por el Comité de Ética Institucional de cada centro participante, y todos los pacientes suministraron su consentimiento informado. Luego de un implante exitoso de un dispositivo de TRC, y antes del alta, los pacientes fueron asignados en forma randomizada a sobreestimulación auricular versus sin sobreestimulación auricular por la duración del seguimiento (NCT00187252).
Definiciones
Los pacientes fueron clasificados en un grupo con FA de nuevo inicio, si 1) no tenían historia de FA al ingresar al estudio, y 2) desarrollaron FA documentada en un electrocardiograma durante el seguimiento, o durante un evento adverso o internación. Esta definición es similar a la de Hoppe y cols, en el análisis retrospectivo del conjunto de datos del CARE-HF (10). La FA permanente se definió como FA antigua para la cual la cardioversión no se había indicado o intentado, como se describió en las guías profesionales europeas y norteamericanas para el tratamiento de pacientes con FA (18).
Objetivos del estudio (Diapositiva 5)

El objetivo primario fue la incidencia de FA permanente durante 12 meses de seguimiento. Los objetivos secundarios fueron 1) la incidencia de FA de nuevo inicio, 2) cambios en la FEVI y las dimensiones, 3) los cambios en la clase funcional NYHA y la calidad de vida, evaluados según el cuestionario Minnesota Living With Heart Failure®, y 4) la mortalidad.
Sistemas de terapia de resincronización cardíaca
Todos los pacientes se sometieron a implante de dispositivo de TRC Frontier™ o Frontier II, dispositivo de TRC con desfibrilación Epic™ HF o Atlas™ (St Jude Medical). Todos los dispositivos incluyen el algoritmo AF Suppression™. La función de sobreestimulación auricular aumenta la frecuencia de estimulación cuando 2 eventos auriculares intrínsecos se detectan en 16 ciclos. Una vez que se ha logrado una estimulación estable, el sistema estimula en la frecuencia de sobreestimulación por 15 ciclos. Si durante un período de sobreestimulación auricular, se detectan ondas P intrínsecas, el algoritmo aumenta la frecuencia de estimulación una vez más hasta un máximo de 110 lpm. Si no se detecta onda P intrínseca durante la sobreestimulación auricular, el algoritmo extiende el intervalo entre los eventos estimulados consecutivos, enlenteciendo gradualmente la frecuencia de estimulación hasta la frecuencia de base programada, o hasta la frecuencia definida por el sensor.
Selección de pacientes y randomización
Los pacientes fueron elegibles para ingresar al estudio si cumplían con los siguientes criterios: 1) clase funcional NYHA III o IV, a pesar de terapia médica óptima, 2) duración QRS ≥130 ms, 3) FEVI ≤35%, 4) diámetro diastólico final del VI ≥55 mm. Los criterios de exclusión fueron 1) FA permanente, 2) infarto de miocardio, cirugía cardíaca o procedimiento de revascularización coronaria dentro de los 3 meses previos, 3) <6 meses de expectativa de vida por otro trastorno que no fuera la ICC o embarazo.
La asignación al azar de los pacientes al grupo de tratamiento versus el grupo de control se realizó y coordinó en forma centralizada por el espónsor del estudio.
Cálculo de la magnitud de la muestra
Al menos 379 pacientes se necesitaron para el estudio para detectar una reducción absoluta de 6,2% en el desarrollo de FA permanente entre los grupos de control y tratamiento, asumiendo un nivel de significancia unilateral de 5%, con un poder de 80%.
Análisis estadístico
Todos los análisis se basaron en el principio de intención de tratar. Los datos recolectados en los 2 grupos se compararon a los 12 meses. La normalidad de los datos se verificó usando diagramas de caja normales de probabilidades, y pruebas de Kolmogorov-Smirnov para la normalidad. Las variables continuas de distribución normal se compararon usando la prueba t de dos muestras para variables independientes. Se usaron las pruebas no paramétricas de Wilcoxon-Mann-Whitney y de rango de signos de Wilcoxon para las variables no normales. Se llevaron a cabo análisis de regresión logística de exploración, para calcular el grado en el que las variables seleccionadas se asociaron independientemente con el desarrollo de FA permanente y muerte por todas las causas. Un valor de P <0,05 fue considerado significativo.
Resultados
Entre septiembre de 2003 y marzo de 2006, 409 pacientes fueron reclutados en el ensayo MASCOT, en 34 centros médicos en 10 países. Su edad promedio fue 68±10 años, FEVI promedio 25±6%, 203 pacientes (49,6%) sufrían cardiopatía isquémica, 350 (85,6%) estaban en clase funcional III de NYHA y 78 pacientes (19%) tenían historia de FA paroxística. Las características basales de la población del estudio se detallan en las diapositivas 6,7,8,9.
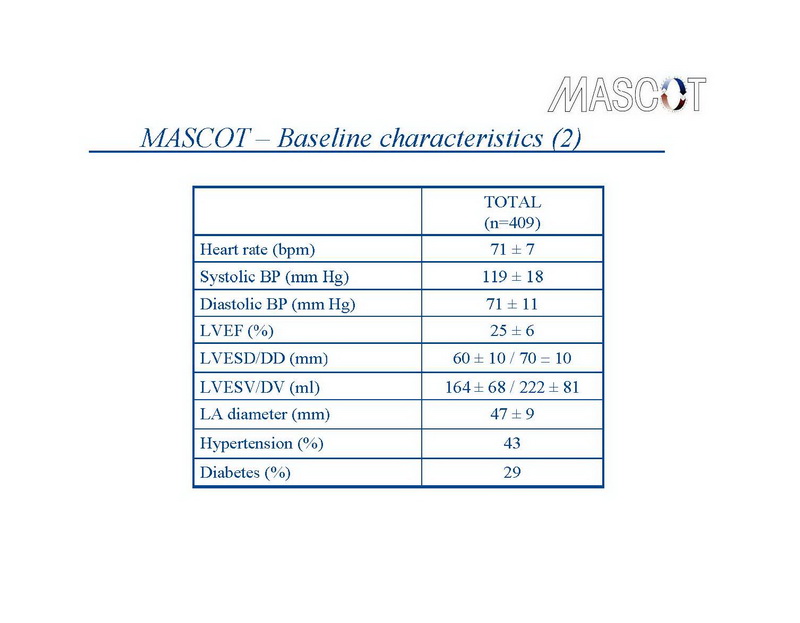
Más del 90% de los pacientes fueron tratados con inhibidores de la enzima convertidora de angiotensina o bloqueantes del receptor de angiotensina, o diuréticos, o ambos, y el 72% con bloqueantes beta adrenérgicos y el 29% con drogas antiarrítmicas.
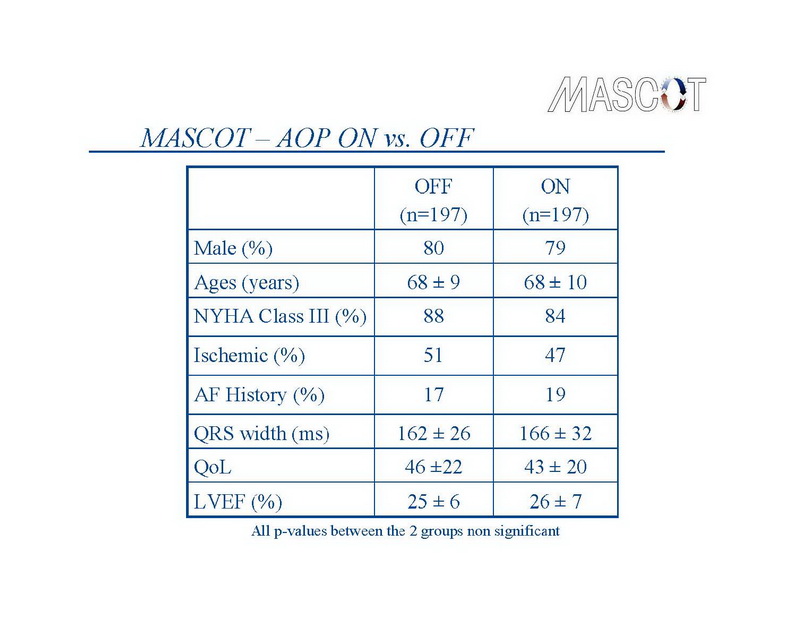
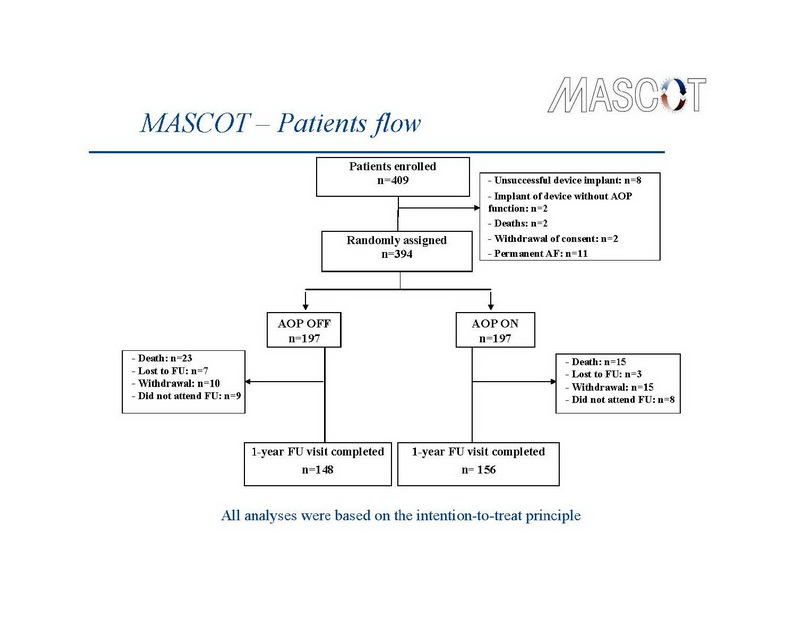
Los dispositivos de TRC se implantaron con éxito en 394 pacientes. La elección del dispositivo se dejó en manos de los investigadores. Los dispositivos de TRC-D se implantaron en 228 y dispositivos de TRC-P en 174 pacientes. La derivación de la aurícula derecha se implantó en el apéndice en el 91% de los pacientes, el 81% de las derivaciones del VD se colocaron en el ápice, y el 69% de las derivaciones del VI se implantaron en la posición lateral o póstero-lateral. Estos 394 pacientes fueron asignados al azar a sobreestimulación auricular (grupo de tratamiento – n=197) versus sin sobreestimulación auricular (grupo de control – n=197). Las características basales de los 2 grupos de estudio fueron similares. A 1 año, 323 pacientes permanecieron en el estudio, de los cuales 148 en el grupo de control y 156 en el grupo de tratamiento asistieron a las visitas del seguimiento de 12 meses. El flujo de pacientes durante el curso del estudio de muestra en la diapositiva 10.
Respuesta a la terapia de resincronización cardíaca
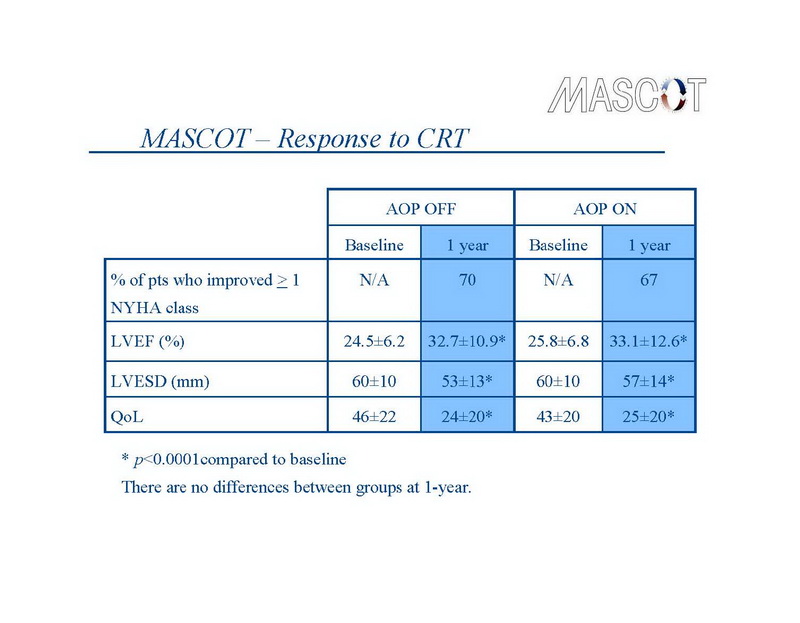
En ambos grupos de estudio, la TRC produjo cambios consistentes con mejoras considerables en la función cardíaca y la atenuación de los síntomas de IC (Diapositiva 11).
La clase NYHA disminuyó en ≥1 clase en el 70% de los pacientes en el grupo de control versus el 67% de los pacientes en el grupo de tratamiento. En forma similar, el puntaje de calidad de vida disminuyó (indicando una mejora en la calidad de vida) de 46±22 a 24±20 en el grupo de control (P<0,0001) y de 43±20 a 25±20 en el grupo de tratamiento (P<0,0001). El diámetro sistólico final del VI disminuyó de 60±10 mm a 53±13 mm en el grupo de control, y de 60±10 mm a 57±14 mm en los grupos de tratamiento (ambos P<0,0001), mientras que la FEVI aumentó de 24,5±6,2% a 32,7±10,9% en el grupo de control, y de 25,8±6,8% a 33,1±12,6% en el grupo de tratamiento (ambos P<0,0001). Las diferencias entre grupos en estas mediciones a 1 año no fueron estadísticamente significativas.
Efecto de la sobreestimulación auricular
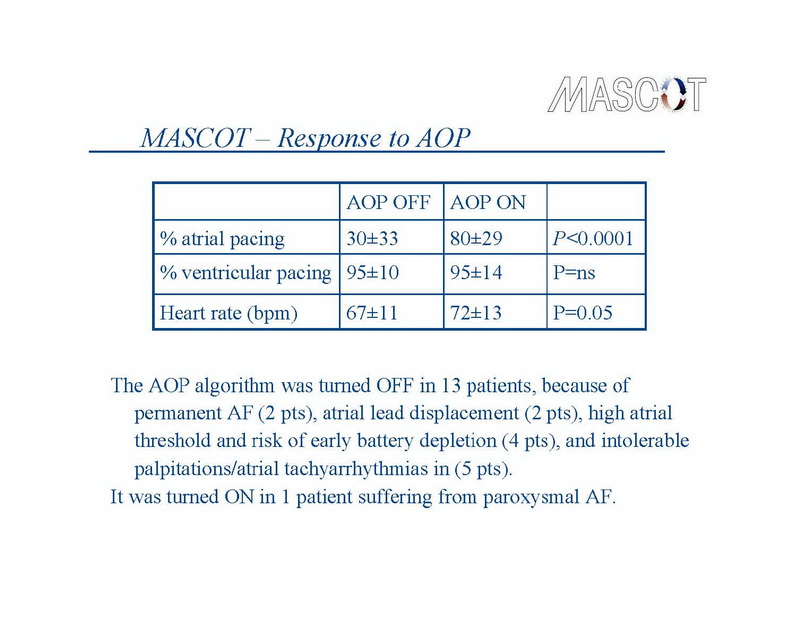
El porcentaje promedio de la estimulación auricular fue 80±29% en el grupo de tratamiento versus 30±33% en el grupo de control (P<0,0001). Los porcentajes promedio respectivos de estimulación ventricular fueron 95±14% versus 95±10% (no significativo), como era de esperarse en pacientes que habían recibido dispositivos de TRC. La frecuencia cardíaca promedio fue 67±11 lpm en el grupo de control versus 72±13 lpm en el grupo de tratamiento (P=0,05) (Diapositiva 8). El algoritmo de sobreestimulación auricular se apagó durante el seguimiento en 13 pacientes, por la FA permanente en 2 pacientes, desplazamiento de la derivación auricular en 2, un umbral auricular alto y riesgo de agotamiento precoz de la batería en 4, y taquiarritmias auriculares/palpitaciones intolerables en 5 pacientes. Se reprogramó de apagado a encendido en 1 paciente que sufría FA paroxística.
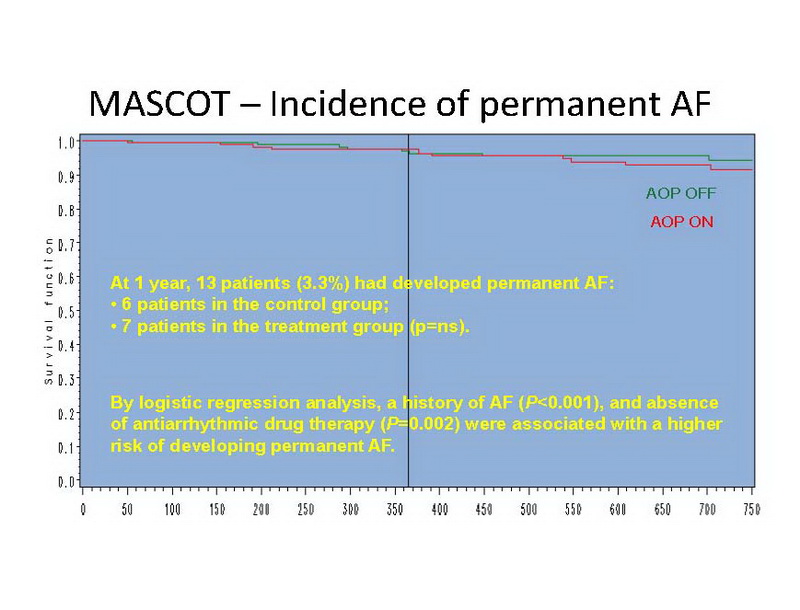
A 1 año, la FA permanente se había desarrollado en 13 pacientes (3,3%): 6 pacientes en el grupo de control, versus 7 pacientes en el grupo de tratamiento (no significativo) (Diapositiva 12).
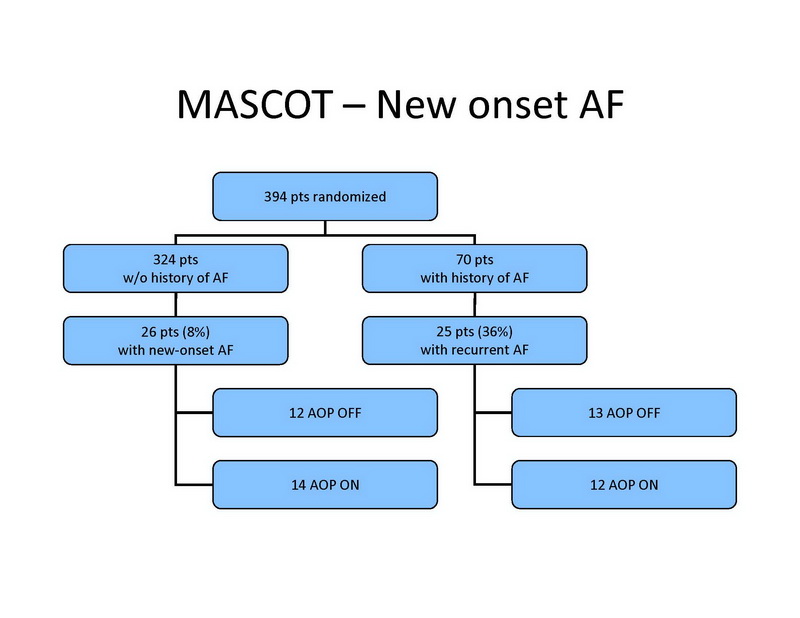
Entre 394 pacientes sin historia de FA, 26 (8%) desarrollaron FA de nuevo inicio, incluyendo 20 pacientes con FA paroxística y 6 con FA permanente. La FA de nuevo inicio se desarrolló en 12 pacientes en el grupo de control, versus 14 pacientes en el grupo de tratamiento (no significativo) (Diapositiva 13).
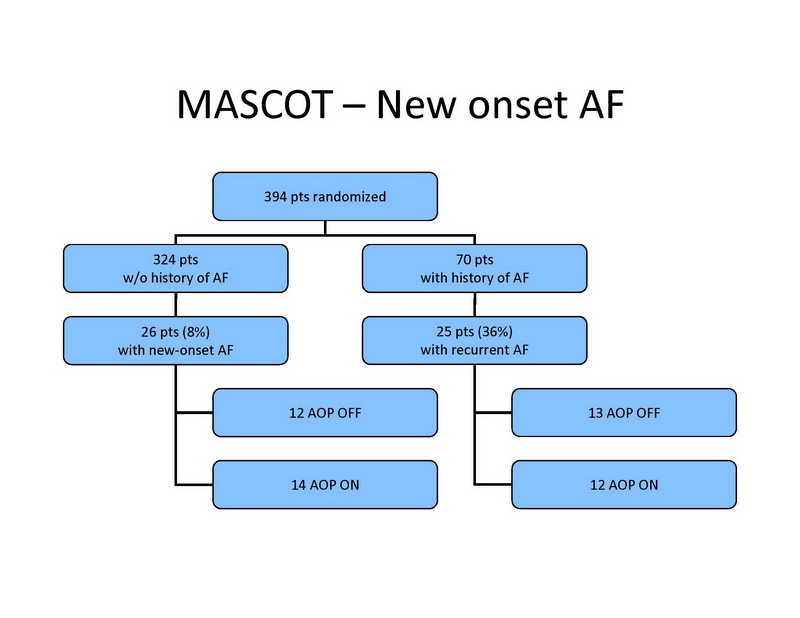
Entre los 70 pacientes con historia de FA basal, 25 tuvieron recurrencias de FA durante el seguimiento, y FA permanente en 7 pacientes. La FA recurrente se documentó en 13 pacientes en el grupo de control, versus 12 pacientes en el grupo de tratamiento (no significativo).
Por análisis de regresión logística, historia de FA (P<0,0001) y ausencia de terapia antiarrítmica (P=0,002) se asociaron con un riesgo mayor de desarrollo de FA permanente.
Muertes durante el seguimiento
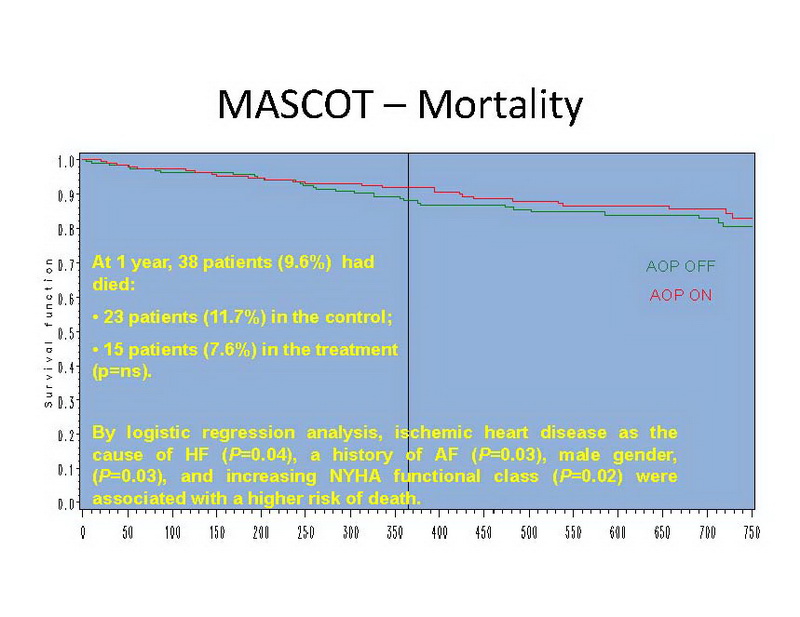
Durante el período de 1 año de seguimiento, 38 pacientes (9,6%) murieron, incluyendo 23 pacientes (11,7%) en el grupo de control y 15 pacientes (7,6%) en el grupo de tratamiento, una diferencia estadísticamente no significativa (Diapositiva 14).
Las causas de muerte fueron cardíacas en 23, no cardíacas en 9 y por causas desconocidas en 6 pacientes. Por análisis de regresión logística, la cardiopatía isquémica como causa de IC (P=0,04), historia de FA (P=0,03), sexo masculino (P=0,03) y una clase funcional NYHA creciente (P=0,02) se asociaron a un mayor riesgo de muerte.
Discusión
El MASCOT es el primer ensayo que evaluó prospectivamente la incidencia de FA permanente y no permanente, y el posible beneficio preventivo conferido por la sobreestimulación auricular en una población de pacientes que recibieron TRC. Unos pocos estudios pequeños y retrospectivos (11,19,20), y un análisis post hoc del ensayo CARE-HF (10), han examinado los efectos de la TRC sobre el desarrollo de la FA, mientras que la prevención de la FA en los pacientes que reciben TRC no se ha estudiado. Las características basales de los pacientes inscriptos en el MASCOT, similares a las de los pacientes inscriptos en el CARE-HF, son representativas de los candidatos a TRC. Fung y cols compararon la incidencia de FA de nuevo inicio en pacientes tratados con TRC y en un grupo de control pareados por un período de 3 años (20). La incidencia anual de la FA de nuevo inicio, detectada durante las visitas al hospital por evaluaciones clínicas, fue de 2,8% en pacientes que recibieron dispositivos de TRC, versus 10,2% en el grupo de control, lo que sugiere un efecto preventivo de la TRC contra la FA. Huegl y cols observaron una disminución de la carga de FA detectada por el diagnóstico del dispositivo, durante los primeros 3 meses luego del implante del dispositivo, en un grupo pequeño de pacientes que recibieron dispositivo de TRC (19). En tal estudio, la ocurrencia de FA no se relacionó con historia previa de FA, ni interfirió con la respuesta a la TRC. Adelstein y cols usaron el diagnóstico del dispositivo para comparar un grupo de pacientes que se sometieron a implante no exitoso de los dispositivos de TRC, con los pacientes que recibieron dispositivos de TRC que respondieron o no a la terapia de resincronización (11). Durante el seguimiento de 1 año, no se observó una diferencia en la incidencia de FA entre los controles y los pacientes que recibieron el dispositivo de TRC, y entre los pacientes que respondían a la TRC y los que no lo hacían.
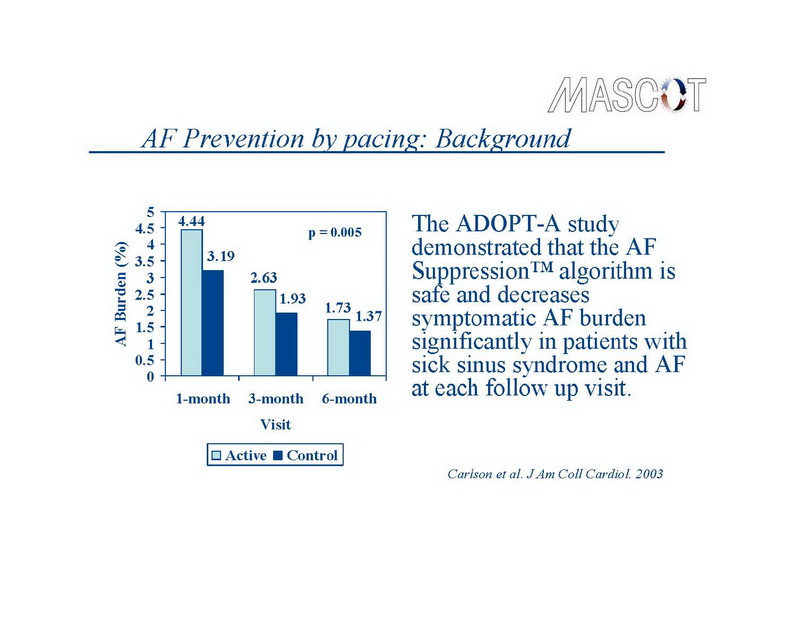
En un análisis post hoc del estudio CARE-HF (10), la prevalencia de FA en el grupo tratado con TRC fue 19% en la línea basal, y FA de nuevo inicio se desarrolló en el 16% durante los 29 meses de seguimiento. La TRC no afectó el desarrollo de la FA y por el contrario, la FA no anuló los efectos terapéuticos de la TRC. En un análisis no publicado del ensayo COMPANION, la prevalencia de la FA basal fue 17% y la incidencia de la FA de nuevo inicio fue 16% en 15 meses (21). En este estudio, se comparó el tratamiento farmacológico óptimo con la TRC, que no disminuyó la incidencia de FA detectada por las evaluaciones clínicas durante las visitas al hospital. Finalmente, en un estudio de 319 pacientes estimulados, con historia de FA, Carlson y cols observaron una reducción relativa de 25% de la carga sintomática de FA por sobreestimulación auricular comparada con estimulación convencional (14).
En el MASCOT, basado en una revisión de archivos médicos, la prevalencia de FA basal fue del 19%, la incidencia a 1 año de la FA de nuevo inicio fue 8%, y la incidencia de FA permanente fue 3,3%. Una historia de FA y la ausencia de drogas antiarrítmicas en el momento de la inclusión en el estudio se asociaron con el desarrollo de FA permanente. La programación de la sobreestimulación auricular se toleró bien y aumentó el porcentaje de la estimulación auricular en forma significativa, de 30% a 80%, mientras que la frecuencia cardíaca promedio aumentó sólo ligeramente. Sin embargo, en contraste con sus efectos en los pacientes estimulados con enfermedad del nodo sinusal (14), habilitar esta función en este estudio no tuvo ningún efecto sobre la incidencia de FA permanente o de nuevo inicio. Ni la sobreestimulación auricular ni el desarrollo de FA permanente o de nuevo inicio interfirieron con la respuesta a la TRC.
Todos los estudios de TRC se han realizado con rastreo auricular, estimulación biventricular (modo VDD), lo que resultó en ausencia de estimulación auricular. En la práctica, la mayoría de los dispositivos están programados en modo DDD, resultando en estimulación auricular cuando la frecuencia cardíaca intrínseca cae por debajo de la frecuencia de respaldo programada. Esto permite la optimización de la terapia farmacológica, incluyendo la prescripción de bloqueantes beta adrenérgicos (22,23). En este ensayo, el porcentaje de estimulación auricular en el grupo de control fue 30%. El efecto de este porcentaje de estimulación auricular sobre el desarrollo de FA se desconoce, y puede haber interferido con los resultados del estudio.
Los resultados de análisis multivariado versus mortalidad son concordantes con las observaciones hechas por Gasparini y cols (32), que hallaron que la IC por cardiopatía isquémica y la clase funcional IV de NYHA predijo una mortalidad aumentada. El posible impacto de una historia de FA sobre la mortalidad confirma la necesidad de investigar más el desarrollo de FA en pacientes que sufren de IC.
Limitaciones de nuestro estudio
La incidencia de FA se midió sobre la base de la información clínica disponible durante las visitas al hospital. La baja incidencia de FA permanente, que no permitió probar el objetivo primario del estudio, es otra limitación importante. No resulta claro si esta baja incidencia de FA es el resultado de un posible efecto beneficioso de la TRC.
Conclusiones
Los resultados de este primer ensayo de prevención de FA en pacientes que recibieron dispositivos de TRC mostraron que la sobreestimulación auricular era segura en pacientes que sufrían de IC y función ventricular deprimida. Mientras que el algoritmo aumentó efectivamente el porcentaje de estimulación auricular de 30% a 80%, no disminuyó la incidencia de FA permanente en el seguimiento de 1 año. Los pacientes serán seguidos por otro año para confirmar estos resultados. (Diapositiva 15)

Referencias
1. Wang TJ, Larson MG, Levy D, Vasan RS, Leip EP, Wolf PA, D'Agostino RB, Murabito JM, Kannel WB, Benjamin EJ. Temporal relations of atrial fibrillation and congestive heart failure and their joint influence on mortality: the Framingham Heart Study. Circulation. 2003; 107: 2920-5.
2. Maisel WH, Stevenson LW. Atrial fibrillation in heart failure: epidemiology, pathophysiology, and rationale for therapy. Am J Cardiol. 2003;91(6A):2D-8D.
3. Sanders P, Morton JB, Davidson NC, Spence SJ, Vohra JK, Sparks PB, Kalman JM. Electrical remodeling of the atria in congestive heart failure: electrophysiological and electroanatomic mapping in humans. Circulation. 2003; 108: 1461-8.
4. Swedberg K, Olsson LG, Charlesworth A, Cleland J, Hanrath P, Komajda M, Metra M, Torp-Pedersen C, Poole-Wilson P. Prognostic relevance of atrial fibrillation in patients with chronic heart failure on long-term treatment with beta-blockers: results from COMET. Eur Heart J. 2005; 26: 1303-8.
5. Baldasseroni S, De Biase L, Fresco C, Marchionni N, Marini M, Masotti G, Orsini G, Porcu M, Pozzar F, Scherillo M, Maggioni AP; Italian Network on Congestive Heart Failure. Cumulative effect of complete left bundle-branch block and chronic atrial fibrillation on 1-year mortality and hospitalization in patients with congestive heart failure. A report from the Italian network on congestive heart failure (in-CHF database). Eur Heart J. 2002; 23: 1692-8.
6. Cazeau S, Leclercq C, Lavergne T, Walker S, Varma C, Linde C, Garrigue S, Kappenberger L, Haywood GA, Santini M, Bailleul C, Daubert JC; Multisite Stimulation in Cardiomyopathies (MUSTIC) Study Investigators. Effects of multisite biventricular pacing in patients with heart failure and intraventricular conduction delay. N Engl J Med. 2001; 344: 873-80.
7. Abraham WT, Fisher WG, Smith AL, Delurgio DB, Leon AR, Loh E, Kocovic DZ, Packer M, Clavell AL, Hayes DL, Ellestad M, Trupp RJ, Underwood J, Pickering F, Truex C, McAtee P, Messenger J; MIRACLE Study Group. Multicenter InSync Randomized Clinical Evaluation. Cardiac resynchronization in chronic heart failure. N Engl J Med. 2002; 346: 1845-53.
8. Bristow MR, Saxon LA, Boehmer J, Krueger S, Kass DA, De Marco T, Carson P, DiCarlo L, DeMets D, White BG, DeVries DW, Feldman AM; Comparison of Medical Therapy, Pacing, and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac-resynchronization therapy with or without an implantable defibrillator in advanced chronic heart failure. N Engl J Med. 2004; 350: 2140-50.
9. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L; Cardiac Resynchronization-Heart Failure (CARE-HF) Study Investigators. The effect of cardiac resynchronization therapy on morbidity and mortality in heart failure (the CArdiac REsynchronization-Heart Failure [CARE-HF] Trial). N Engl J Med. 2005; 352: 1539-49.
10. Hoppe UC, Casares JM, Eiskjaer H, Hagemann A, Cleland JG, Freemantle N, Erdmann E. Effect of cardiac resynchronization on the incidence of atrial fibrillation in patients with severe heart failure. Circulation. 2006; 114: 18-25.
11. Adelstein EC, Saba S. Burden of atrial fibrillation after cardiac resynchronization therapy. Am J Cardiol. 2007; 100: 268-72.
12. Knight BP, Desai A, Coman J, Faddis M, Yong P. Long-term retention of cardiac resynchronization therapy. J Am Coll Cardiol. 2004; 44: 72-77.
13. Gasparini M, Auricchio A, Regoli F, Fantoni C, Kawabata M, Galimberti P, Pini D, Ceriotti C, Gronda E, Klersy C, Fratini S, Klein HH. Four-year efficacy of cardiac resynchronization therapy on exercise tolerance and disease progression: the importance of performing atrioventricular junction ablation in patients with atrial fibrillation. J Am Coll Cardiol. 2006; 48: 734-743.
14. Carlson MD, Ip J, Messenger J, Beau S, Kalbfleisch S, Gervais P, Cameron DA, Duran A, Val-Mejias J, Mackall J, Gold M; Atrial Dynamic Overdrive Pacing Trial (ADOPT) Investigators. A new pacemaker algorithm for the treatment of atrial fibrillation: results of the Atrial Dynamic Overdrive Pacing Trial (ADOPT). J Am Coll Cardiol. 2003; 42: 627-633.
15. Padeletti L, Purerfellner H, Adler SW, Waller TJ, Harvey M, Horvitz L, Holbrook R, Kempen K, Mugglin A, Hettrick DA; Worldwide ASPECT Investigators. Combined efficacy of atrial septal lead placement and atrial pacing algorithms for prevention of paroxysmal atrial tachyarrhythmia. J Cardiovasc Electrophysiol. 2003; 14: 1189-95.
16. Lee MA, Weachter R, Pollak S, Kremers MS, Naik AM, Silverman R, Tuzi J, Wang W, Johnson LJ, Euler DE; ATTEST Investigators. The effect of atrial pacing therapies on atrial tachyarrhythmia burden and frequency: results of a randomized trial in patients with bradycardia and atrial tachyarrhythmias. J Am Coll Cardiol. 2003; 41: 1926-32.
17. Padeletti L, Musilli N, Porciani MC, Colella A, Di Biase L, Ricciardi G, Pieragnoli P, Michelucci A, Gensini G. Atrial fibrillation and cardiac resynchronization therapy: the MASCOT study. Europace. 2004; 5 Suppl 1: S49-54.
18. Fuster V, Ryden LE, Asinger RW, Cannom DS, Crijns HJ, Frye RL, Halperin JL, Kay GN, Klein WW, Levy S, McNamara RL, Prystowsky EN, Wann LS, Wyse DG; American College of Cardiology; American Heart Association; European Society of Cardiology; North American Society of Pacing and Electrophysiology. ACC/AHA/ESC guidelines for the management of patients with atrial fibrillation. A report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines and Policy Conferences (Committee to develop guidelines for the management of patients with atrial fibrillation) developed in collaboration with the North American Society of Pacing and Electrophysiology. Eur Heart J. 2001; 22: 1852-923.
19. Huegl B, Bruns HJ, Unterberg-Buchwald C, Grosse A, Stegemann B, Lauer B, Geller JC, Gasparini M. Atrial fibrillation burden during the post-implant period after CRT using device-based diagnostics. J Cardiovasc Electrophysiol. 2006; 17: 813-817.
20. Fung JW, Yu CM, Chan JY, Chan HC, Yip GW, Zhang Q, Sanderson JE. Effects of cardiac resynchronization therapy on incidence of atrial fibrillation in patients with poor left ventricular systolic function. Am J Cardiol. 2005; 96: 728-31.
21. Saxon LA. Does cardiac resynchronization therapy reduce the incidence of atrial fibrillation, and does atrial fibrillation compromise the cardiac resynchronization therapy effect? Heart Rhythm. 2007; 4(3 Suppl): S31-33.
22. Stecker EC, Fendrick AM, Knight BP, Aaronson KD. Prophylactic pacemaker use to allow beta-blocker therapy in patients with chronic heart failure with bradycardia. Am Heart J. 2006; 151: 820-828
23. Aranda JM Jr, Woo GW, Schofield RS, Handberg EM, Hill JA, Curtis AB, Sears SF, Goff JS, Pauly DF, Conti JB. Management of heart failure after cardiac resynchronization therapy: integrating advanced heart failure treatment with optimal device function. J Am Coll Cardiol. 2005; 46: 2193-2198.
24. Ellenbogen KA. Pacing therapy for prevention of atrial fibrillation. Heart Rhythm. 2007; 4(3 Suppl): S84-87
25. Garrigue S, Barold SS, Cazeau S, Gencel L, Jais P, Haissaguerre M, Clementy J. Prevention of atrial arrhythmias during DDD pacing by atrial overdrive. Pacing Clin Electrophysiol. 1998; 21: 1751-9.
26. Yu CM, Fang F, Zhang Q, Yip GW, Li CM, Chan JY, Wu L, Fung JW. Improvement of atrial function and atrial reverse remodeling after cardiac resynchronization therapy for heart failure. J Am Coll Cardiol. 2007; 50: 778-85.
27. Vural A, Agacdiken A, Ural D, Sahin T, Kozdag G, Kahraman G, Ural E, Akbas H, Suzer K, Komsuoglu B. Effect of cardiac resynchronization therapy on left atrial appendage function and pulmonary venous flow pattern. Int J Cardiol. 2005; 102: 103-109.
28. Shinagawa K, Shi Y-F, Tardiff J-C, Leung T-K, Nattel S. Dynamic nature of atrial fibrillation substrate during development and reversal of heart failure in dogs. Circulation. 2002; 105: 2672-2678.
29. Hanna IR, Heeke B, Bush H, Brosius L, King-Hageman D, Dudley SC Jr, Beshai JF, Langberg JJ. Lipid-lowering drug use is associated with reduced prevalence of atrial fibrillation in patients with left ventricular systolic dysfunction. Heart Rhythm. 2006; 3: 881-886.
30. Healey JS, Baranchuk A, Crystal E, Morillo CA, Garfinkle M, Yusuf S, Connolly SJ.
Prevention of atrial fibrillation with angiotensin-converting enzyme inhibitors and angiotensin receptor blockers: a meta-analysis. J Am Coll Cardiol. 2005; 45: 1832-1839.
31. Noelker G, Marschang H, Gutleben K, Schibgilla V, Boileau P, Huemmer A,Hallier B, Brachmann J. Dynamic ventricular overdrive for rate regularization during atrial fibrillation. Europace. 2007; 9(Supp 3): 45. Abstract.
32. Gasparini M, Lunati M, Santini M, Tritto M, Curnis A, Bocchiardo M, Vincenti A, Pistis G, Valsecchi S, Denaro A; INSYNC/INSYNC ICD ITALIAN Registry Investigators.
Long-term survival in patients treated with cardiac resynchronization therapy: a 3-year follow-up study from the InSync/InSync ICD Italian Registry. Pacing Clin Electrophysiol. 2006; 29 Suppl 2: S2-10. |


