Lectures
Evaluación de la disincronía: Otras técnicas
Foley, Paul / Leyva, Francisco
Introducción
Según el paradigma aceptado actualmente que abala la terapia de resincronización cardíaca (TRC), la disincronía cardíaca contribuye al síndrome de insuficiencia cardíaca y su correlación resulta en un beneficio clínico. El primer testimonio de este paradigma fue presentado por Cazeau y cols, que en 1994 informaron sobre la mejora clínica dramática de un hombre de 54 años que fue tratado con estimulación de las cuatro cámaras (1). En un estudio hemodinámico agudo, Leclerq y cols, mostraron posteriormente que la terapia temporal de resincronización cardíaca (TRC) con estimulación biventricular resultaba en un aumento del gasto del ventrículo izquierdo (VI) y en una disminución de la presión capilar pulmonar en cuña (2). En un informe sobre 27 pacientes con insuficiencia cardíaca terminal, Auricchio y cols, mostraron que la TRC resultó en un aumento de la presión de pulso aórtico y dP/dt del VI, que se revirtió inmediatamente luego de retirar la estimulación (3). El estudio MUSTIC (Estimulación Multisitio en Miocardiopatías), simple ciego y cruzado de 67 pacientes, mostró que la TRC redujo dramáticamente las internaciones por insuficiencia cardíaca y mejoró la clase NYHA, así como la calidad de vida, la distancia recorrida y la captación máxima de oxígeno (4). El ensayo con resultados más importantes sobre estimulación TRC, el CARE-HF (Resincronización cardíaca en insuficiencia cardíaca), mostró que esta terapia resultó en una reducción relativa de 36% de la mortalidad total (5). El estudio COMPANION (Comparación de terapia médica, estimulación y desfibrilación en insuficiencia cardíaca) mostró que la adición de un cardiodesfibrilador para la TRC-D también resultaba en un beneficio en la mortalidad (6).
Varios mecanismos se han postulado hasta ahora como explicaciones posibles para los efectos beneficiosos de la TRC. La interacción ventricular diastólica, que es demostrable en pacientes con insuficiencia cardíaca (7), es aliviada tanto por la estimulación biventricular como del VI (8). Además, la TRC reduce la regurgitación mitral funcional, en forma aguda y también a largo plazo (9-11). Los roles del flujo sanguíneo (12), la etiología de la insuficiencia cardíaca (13), la viabilidad miocárdica (14), la ubicación de cicatrices miocárdicas (15) y el ritmo auricular (16,17) también se han explorado. Sin embargo el mecanismo más intuitivo por el que la TRC confiere un beneficio, es mediante la corrección de la disincronía. Mientras que la ecocardiografía es la modalidad de imagen estudiada en forma más generalizada en relación a la evaluación de la disincronía cardíaca, otras técnicas están apareciendo. Esta revisión se enfoca en la evaluación de la disincronía cardíaca con otras técnicas.
Definición de respuesta a la TRC
Para que una prueba sea clínicamente significativa, debe probar su valor cuando se evalúa contra parámetros clínicamente significativos, como síntomas, morbilidad y mortalidad. Puesto que la mortalidad no siempre es una medida practicable para los resultados en estudios que no son ensayos con resultados extensos, las mediciones sustitutas, como el remodelado inverso del VI, se han vuelto populares en los estudios menores.
Para agravar el problema de lo que constituye una respuesta a un tratamiento determinado, un beneficio sintomático no necesariamente se asocia con un beneficio en la sobrevida. En los extremos tenemos a la quimioterapia para el tratamiento del cáncer, que tiene por intención un beneficio en la sobrevida, pero que rara vez implica un beneficio sintomático. Por otro lado, los tratamientos paliativos generalmente ofrecen un alivio de los síntomas, pero no una ventaja para la sobrevida. En este sentido, los datos del estudio CARE-HF sugieren que todos los pacientes tratados con TRC mejoran en relación con los tratados con terapia médica solamente (18). Por otro lado, otros estudios han demostrado que hay una discordancia entre los beneficios en términos de síntomas y de mediciones sustitutas de un beneficio en la sobrevida, como el remodelado inverso del VI (19). Es importante, por lo tanto, calificar si el “índice de respuesta” se refiere a un beneficio de la sobrevida o de los síntomas, o ambos. Este problema de la definición de respuesta se aplica a la mayoría de los estudios de TRC.
Como una limitación más, el término “paciente que responde” no incorpora la medición del grado en el que un tratamiento evita el deterioro, a menos que se compare con el placebo. Luego de la publicación de las guías clínicas, sin embargo, la TRC no puede compararse con el placebo. Por esta razón, el índice de pacientes que responden citado en algunos estudios (no incluyendo el CARE-HF y el COMPANION), no refleja por lo tanto, los efectos de la TRC sobre la prevención del deterioro clínico, como sería de esperarse por la historia natural de la insuficiencia cardíaca. Éste es un factor importante a tomar en cuenta en la interpretación de los hallazgos de los estudios de la TRC.
Ecocardiografía
Los estudios ecocardiográficos de la respuesta a la TRC se han enfocado en mediciones sustitutas de la mortalidad, la más popular de ellas siendo el remodelado inverso del VI. Varios grupos han empleado mediciones derivadas de las imágenes por Doppler tisular (DT) de la dispersión temporal de la velocidad del tiempo hasta el máximo de los segmentos miocárdicos como un predictor de respuesta a la TRC (20-23). Juntos, estos estudios han respaldado la noción de que la demostración de la disincronía cardíaca previa al implante es un requerimiento para beneficiarse con la TRC (24,25).
El estudio Predictores de Respuesta a la TRC (PROSPECT) fue el primer estudio multicéntrico en evaluar la ecocardiografía como predictor de respuesta a la TRC (26). Aunque ha surgido cierta preocupación sobre la calidad de la adquisición de datos, recolección de datos y diseño del estudio (27), los autores de la publicación original concluyeron que ninguna medición ecocardiográfica simple podría recomendarse en la selección de pacientes para la TRC. Sobre esta base, la American Society of Echocardiography ha recomendado que las mediciones ecocardiográficas de disincronía no deberían emplearse en la selección de pacientes para la TRC (28). Además del United Kingdom National Institute of Clinical Excellence, ningún grupo de guías clínicas ha adoptado la ecocardiografía para seleccionar paciente para la TRC.
El estudio PROSPECT ha estimulado una recapitulación el papel de las mediciones ecocardiográficas de disincronía en la selección de pacientes para la TRC. En una revisión reciente, Marwick denominó a las numerosas mediciones de disincronía como la torre de Babel (29). En esta revisión, Marwick alude a las limitaciones del DT para medir la disincronía. También se refiere a la poca practicidad clínica de las numerosas técnicas empleadas para cuantificar la disincronía. A este respecto, han surgido algunas anomalías de definición. Varios grupos han mostrado, por ejemplo, que incluso los controles sanos presentan disincronía (30-33). Otros han mostrado que algunos pacientes con insuficiencia cardíaca y QRS ancho no satisfacen los criterios ecocardiográficos de disincronía (34). Mientras que la ecocardiografía plantea con cierta arrogancia sobre una exquisitamente alta resolución temporal, esto puede en realidad ser perjudicial, puesto que también aumenta el “ruido” (35). Luego de una década de investigación, no hay un consenso con respecto al rol de la ecocardiografía en la cuantificación de la disincronía con el propósito de seleccionar pacientes para la TRC.
Imágenes nucleares
La gammagrafía miocárdica permite la medición de los volúmenes ventriculares, la perfusión miocárdica y el movimiento miocárdico. Para evaluar el valor pronóstico de la disincronía inter e intraventricular, Fauchier y cols, estudiaron 103 pacientes con miocardiopatía no isquémica, 25% de los cuales tenían bloqueo de rama izquierda (BRI) (36). El análisis de fase de Fourier de los datos angiográficos de equilibrio con radionúclidos, se realizó para los ventrículos derecho e izquierdo (Fig. 1).
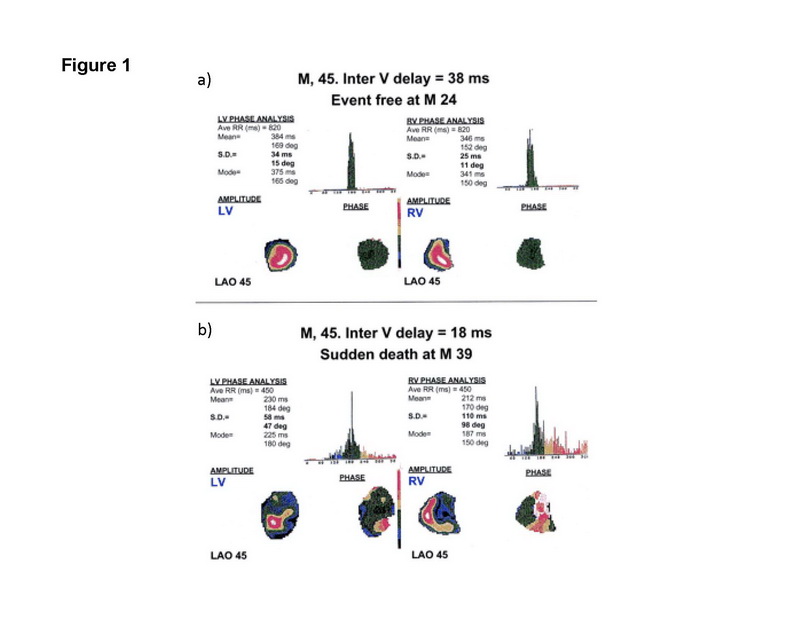
Figura 1: Análisis de fase de datos de ventriculografía por radionúclidos. Las imágenes muestran los ventriculogramas obtenidos de los ventrículos izquierdo y derecho. (a) muestra una fase promedio de 384 ms para el ventrículo izquierdo y 346 ms para el ventrículo derecho, lo que implica una diferencia de fase de 38 ms; (b) muestra una fase promedio de 230 ms para el ventrículo izquierdo y 212 ms para el ventrículo derecho, lo que implica una diferencia promedio de 18 ms. Reproducido con permiso de Fauchier y cols (36).
La diferencia entre la fase promedio de los ventrículos derecho e izquierdo se tomó como medida de disincronía interventricular, mientras que las desviaciones estándar de la fase promedio en cada ventrículo se tomó como medida de la disincronía intraventricular. Los autores hallaron que en un seguimiento promedio de 27 meses, la desviación estándar del VI y la fase promedio del ventrículo derecho (disincronía intraventricular) predijeron eventos cardíacos. Entre los 13 predictores potenciales de eventos cardíacos basados en análisis univariados, una desviación estándar alta de la fase promedio del VI (disincronía intraventricular) y una alta presión capilar pulmonar en cuña surgieron como predictores independientes de eventos cardíacos en análisis multivariados.
Henneman y cols, usaron el análisis de fase de tomografía computada por emisión de fotón único (SPECT) para evaluar la disincronía intraventricular. Se halló que cuatro índices de disincronía derivados del análisis de fase se correlacionaron bien con el retardo de movimiento de la pared septal a posterior en el Doppler tisular (37). En otro estudio de 42 pacientes que se sometieron a TRC, el mismo grupo halló que la desviación estándar de un ángulo de fase de 42º en el SPECT fue el mejor predictor de mejora de la clase NYHA (por ≥1) a los seis meses (área bajo la curva característica del operador receptor de 0,81) (38). Otros grupos han hallado que las mediciones de la disincronía mecánica derivadas de la SPECT, presentan variabilidades bajas intra e inter-observador (39).
Así como ofrece mediciones de la disincronía mecánica, la SPECT también permite la evaluación de la perfusión miocárdica y la viabilidad miocárdica, factores que se sabe son importantes en la respuesta a la TRC (14,15,40,41). En un estudio de 20 pacientes, Sciagra y cols mostraron que, en comparación con los pacientes sin defectos de perfusión, los pacientes con defectos de perfusión que afectan ≥50% de la pared miocárdica en la SPECT, tuvieron una peor calidad de vida y distancia de caminata de 6 minutos a los 3 meses luego de implante del dispositivo de TRC (42). Mientras que se observó un beneficio sobre los síntomas en los pacientes con y sin defectos de perfusión, aquellos con defectos de perfusión no exhibieron un remodelado inverso del VI. En un estudio de 51 pacientes con insuficiencia cardíaca por miocardiopatía isquémica, Ypenburg y cols también mostraron una relación entre la respuesta a la TRC y el grado de miocardio viable y tejido cicatrizal. Además, hasta un 29% con tejido cicatrizal transmural (<50% de actividad de rastreo) en la región de la derivación de la estimulación del VI no mostró mejorías luego de 6 meses de TRC (43). En un estudio retrospectivo de 51 pacientes, Adelstein y cols mostraron que un puntaje bajo de perfusión miocárdica y la densidad promedio de cicatrices en los segmentos inmediatamente adyacentes a la derivación del VI, eran significativamente menores en los pacientes que respondían a la TRC en comparación con los que no lo hacían (respuesta definida como un aumento de ≥15% de la FEVI) (44).
Las imágenes nucleares permiten una evaluación de los pacientes con ventanas ecocardiográficas pobres. Las desventajas, sin embargo, incluyen una baja resolución espacial y temporal y el uso de radiación.
Tomografía computada
La ventriculografía mejorada por contraste que usa la tomografía computada (TC) disponible actualmente, permite delinear en forma adecuada los límites miocárdicos en todo el ciclo cardíaco, así volviéndose una modalidad de imagen potencial para la evaluación de la disincronía mecánica. Truong y cols estudiaron 38 pacientes que se sometieron a TRC con TC de 64 cortes (45). Se observó el contorno de los límites endocárdicos y epicárdicos durante todo el ciclo cardíaco, y cada ciclo se dividió en 10 fases. El índice de disincronía se definió como la desviación estándar del tiempo hasta el grosor máximo de la pared por cada segmento miocárdico. El índice promedio de disincronía fue 152±44 ms para los pacientes con insuficiencia cardíaca y una duración QRS de 65±12 ms para controles pareados por edad. Los autores hallaron un acuerdo excelente entre los dos observadores independientes. Mientras que este índice de disincronía no se evaluó contra el resultado de la TRC, se ha demostrado un buen acuerdo con el rastreo de puntos (45).
Resonancia magnética cardiovascular
La resonancia magnética cardiovascular (RMC) ha sido aceptada en forma generalizada como el gold standard de la investigación para la cuantificación in vivo de los volúmenes ventriculares. Recientemente la RMC se ha aplicado a la evaluación de la disincronía mecánica. Como con otras modalidades de imagen, la disincronía puede medirse en términos de dispersión temporal del movimiento miocárdico. Chalil y cols han usado recientemente la desviación estándar del tiempo hasta el máximo movimiento de la pared en los segmentos miocárdicos como la medida de la disincronía (Fig. 2)(46).
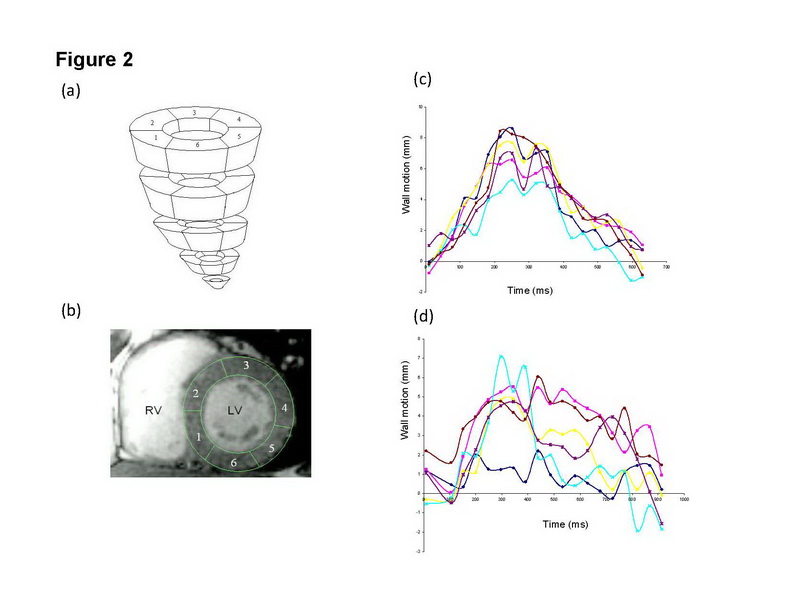
Figura 2: Evaluación de la disincronía mediante el movimiento de la pared, obtenido con resonancia magnética cardiovascular. (a) muestra los cortes del ventrículo izquierdo desde la base (arriba) hacia el ápice (abajo), con cada corte consistiendo en 6 segmentos; (b) muestra el ventrículo izquierdo en el eje corto, con el contorno manual de los límites epicárdicos y endocárdicos del ventrículo izquierdo; (c) muestra el movimiento de la pared ploteado contra el tiempo en un control sano; (d) muestra el movimiento de la pared ploteado contra el tiempo en un paciente con insuficiencia cardíaca y bloqueo de rama izquierda (BRI). Reproducido con permiso de Chalil y cols (46).
En comparación con las mediciones por Doppler tisular de la disincronía, el índice de sincronización del tejido por RMC emergió como un buen discriminador entre los controles sanos y los pacientes con insuficiencia cardíaca (Fig. 3).
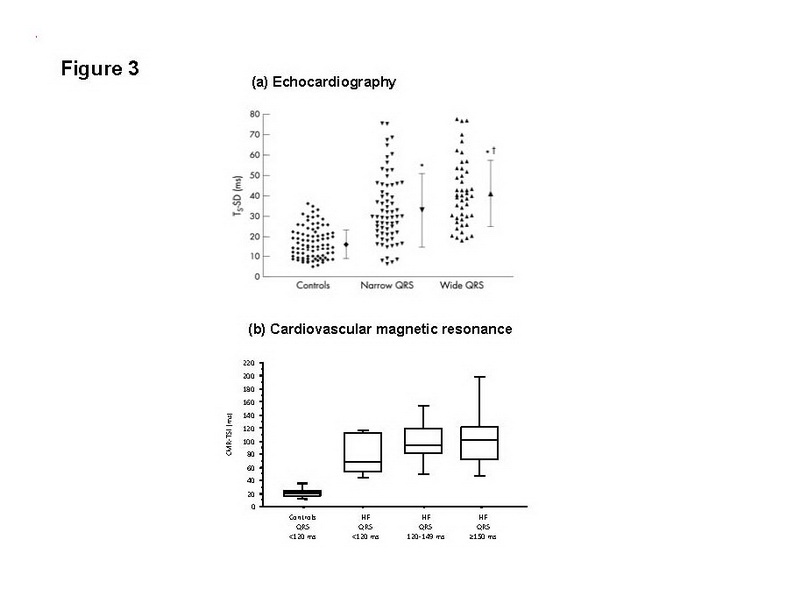
Figura 3: Evaluación de la disincronía en la insuficiencia cardíaca vs. controles. (a) desviación estándar de la velocidad del tiempo hasta el máximo en 12 segmentos miocárdicos derivados del Doppler tisular en controles sanos y en pacientes con insuficiencia cardíaca, con una duración QRS de 120 ms y ≥120 ms [reproducido con permiso de Yu CM y cols (23)]; (b) desviación estándar del tiempo hasta el máximo movimiento de la pared interior (índice de sincronización del tejido por RMC) en controles sanos y en pacientes con insuficiencia cardíaca con duraciones QRS variables (reproducido con permiso de Chalil y cols (46)). Observen la falta de superposición del índice de sincronización del tejido por RMC entre los controles sanos y los pacientes con insuficiencia cardíaca.
Además, el índice de sincronización del tejido por RMC se identificó como un poderoso predictor independiente de morbilidad y mortalidad luego de TRC: los pacientes con un índice de sincronización del tejido por RMC ≥110 ms tuvieron una probabilidad 3,8 veces mayor de morir por causas cardiovasculares, en comparación con los pacientes con un índice de sincronización del tejido por RMC <110 ms. Estos hallazgos respaldan el uso de la evaluación de la disincronía con el uso de RMC en la estratificación de riesgo de pacientes que se someten a la TRC.
Han surgido otros métodos de RMC para evaluar la disincronía cardíaca. La marcación miocárdica (myocardial tagging), que es la técnica considerada el gold standard para evaluar el movimiento miocárdico, permite la evaluación del movimiento de la pared, así como el esfuerzo en las direcciones circunferencial, radial y longitudinal (47,48) (Fig. 4).

Figura 4: Ejemplo de marcaciones de resonancia magnética cardiovascular superpuestas sobre una imagen de eje corto del ventrículo izquierdo. Las marcaciones lineales (señal baja) marcan las áreas del miocardio en todo el ciclo cardíaco. Las líneas parecen “estirarse” durante la sístole. El rastreo del miocardio marcado con un software especializado permite la determinación del movimiento de la pared y el esfuerzo en las direcciones longitudinal, circunferencial y radial.
La RMC con esfuerzo, ofrece una medición cuantitativa en tiempo real del esfuerzo, que puede aplicarse a la evaluación rápida de la disincronía del VI (47). Helm y cols han desarrollado recientemente un método para evaluar la disincronía usando RMC tridimensional de marcación (49). La RMC de codificación por velocidad ha demostrado recientemente tener un concordancia excelente con el Doppler tisular (50). Aunque resulten útiles experimentalmente, estas técnicas no se han validado contra el resultado clínico de la TRC. Su aplicación en la práctica clínica es por lo tanto, limitada.
Mapeo endocárdico
En su forma más simple, la duración QRS del ECG de 12 derivaciones ofrece una medición rudimentaria de la disincronía eléctrica. La distribución de la activación miocárdica, sin embargo, se estudia mejor usando técnicas intracardíacas, como el mapeo endocárdico. Con esta técnica, el grupo de Auricchio ha demostrado que en corazones normales, los sitios de activación más tardía son los segmentos póstero-basal y póstero-lateral (51). En pacientes con insuficiencia cardíaca y bloqueo de rama izquierda (BRI), la activación ventricular sigue un patrón en U, girando el ápice y la pared inferior antes de alcanzar los segmentos póstero-laterales (51). El patrón de activación ventricular en el BRI es muy variable (52), pero la respuesta a la TRC parece ser mayor en los pacientes con evidencias de trastornos de conducción, en relación con la de pacientes con activación homogénea (53).
Al identificar la zona de la activación más tardía, el mapeo sin contacto también ofrece información sobre el mejor sitio para el despliegue de la derivación del VI (54). Lambiase y cols estudiaron 10 pacientes con insuficiencia cardíaca con mapeo endocárdico (55). Presentaron la hipótesis de que la insuficiencia cardíaca responde a los resultados de la TRC de las áreas de estimulación de conducción lenta, mientras que desplegar la derivación en un sitio de activación normal resulta en una respuesta hemodinámica mejorada. En este estudio agudo, los pacientes se sometieron a mapeo sin contacto durante el ritmo sinusal intrínseco y durante el ritmo estimulado. Se usó un catéter ajustable del VI para estimular el VI durante la estimulación biventricular. En los pacientes con miocardiopatía isquémica, se halló una zona de conducción lenta alrededor del seno coronario, con una velocidad 73% más lenta que la pared libre lateral del VI. La estimulación del área de activación normal en vez de una zona de conducción lenta, resultó en un aumento del 22% del dP/dt máximo, lo que representó un aumento del 15% del gasto cardíaco. Este estudio mostró cómo el mapeo sin contacto puede usarse para dirigir el despliegue óptimo de la derivación del VI. Una limitación de los estudios de mapeo endocárdico es que la derivación del VI normalmente está en contacto con el epicardio. No hay seguridad sobre si los hallazgos de los estudios de mapeo endocárdico pueden extrapolarse al epicardio.
Conclusiones
La ecocardiografía es la modalidad estudiada en forma más generalizada para la evaluación de la disincronía mecánica. Mientras que se ha comprobado que diversas mediciones de la disincronía predicen el resultado de la TRC en estudios de centros únicos, las mismas han probado tener una aplicabilidad clínica limitada en un gran estudio multicéntrico. Un mayor refinamiento de las técnicas ecocardiográficas y su aplicación a la selección de candidatos para la TRC son necesarios. Otras técnicas de imagen que usan la RMC, la gammagrafía con radionúclidos y la TC, tienen un potencial en evolución para la selección de pacientes para esta terapia. Por sí solas o en combinación con el mapeo eléctrico, tales técnicas pueden emplearse para derivar mediciones globales y regionales de la disincronía mecánica, que pueden resultar útiles al seleccionar pacientes para la TRC, así como para guiar el despliegue de la derivación del VI. Es necesaria una evaluación adecuada de estas modalidades en relación a objetivos clínicamente significativos antes de introducirlas en la arena clínica.
Referencias
1. Cazeau S, Ritter P, Bakdach S, et al. Four chamber pacing in dilated cardiomyopathy. Pacing Clin Electrophysiol 1994;17:1974-1979.
2. Leclercq C, Cazeau S, Le Breton H, et al. Acute hemodynamic effects of biventricular DDD pacing in patients with end stage heart failure. J Am Coll Cardiol 1998;32:1825-1831.
3. Auricchio A, Stellbrink C, Block M, et al. Effect of Pacing Chamber and Atrioventricular Delay on Acute Systolic Function of Paced Patients with Congestive Heart Failure. Circulation 1999;99:2993-3001.
4. Cazeau S, Leclercq C, Lavergne T, et al. The Multisite Stimulation in Cardiomyopathies Study I. Effects of Multisite Biventricular Pacing in Patients with Heart Failure and Intraventricular Conduction Delay. N Engl J Med 2001;344:873-880.
5. Cleland JG, Daubert JC, Erdmann E, Freemantle N, Gras D, Kappenberger L, Tavazzi L, on behalf of the CArdiac Recynchronization in Heart Failure (CARE-HF) Investigators. The effect of cardiac resynchronization on morbidity and mortality in heart failure. N Engl J Med 2005; 352:1539-1549.
6. Bristow MR, Saxon LA, Borehmer J, et al. for the Comparison of Medical Therapy, Pacing and Defibrillation in Heart Failure (COMPANION) Investigators. Cardiac resynchronization therapy with or without an implantable defibrillator in advanced heart failure. N Eng J Med 2004;350:2140-2150.
7. Atherton JJ, Moore TD, Lele SS, et al. Diastolic ventricular interaction in chronic heart failure. The Lancet 1997;349:1720-1724.
8. Bleasdale RA, Turner MS, Mumford CE, et al. Left ventricular pacing minimizes diastolic ventricular interaction, allowing improved preload-dependent systolic performance. Circulation 2004;110:2395-2400.
9. Ypenburg C, Lancellotti P, Tops LF, Bleeker GB, et al. Acute Effects of Initiation and Withdrawal of Cardiac Resynchronization Therapy on Papillary Muscle Dyssynchrony and Mitral Regurgitation. J Am Coll Cardiol 2007;50:2071-2077.
10. Nunez A, Alberca MT, Francisco G, et al. Severe mitral regurgitation with right ventricular pacing, successfully treated with left ventricular pacing. Pacing Clin Electrophysiol 2002; 25:226-230.
11. Roba M, Anguera I, Champagne J, et al. Left ventricular pacing reduces systolic mitral regurgitation and improves mitral valve closure in heart failure patients with markedly prolonged QRS. Eur Heart J 2000;21:119.
12. Lindner O, Vogt J, Kammeier A, et al. Effect of cardiac resynchronization therapy on global and regional oxygen consumption and myocardial blood flow in patients with non-ischaemic and ischaemic cardiomyopathy. Eur Heart J 2005; 26:70-76.
13. Wikstrom G, Lundqvist CB, Andren B, et al, on behalf of the CARE-HF Investigators. The effects of aetiology on outcome in patients treated with cardiac resynchronization therapy in the CARE-HF trial. Eur Heart J 2009;Epub ahead of print.
14. Chalil S, Foley PWX, Muyhaldeen SA, et al. Late gadolinium enhancement-cardiovascular magnetic resonance as a predictor of response to cardiac resynchronization therapy in patients with ischaemic cardiomyopathy. Europace 2007; 9:1031-1037.
15. Chalil S, Stegemann B, Muhyaldeen S, Khadjooi K, Foley PWX, Smith REA, Leyva F. Effect of posterolateral left ventricular scar on mortality and morbidity following cardiac resynchronization therapy. Pacing Clin Electrophysiol 2007;30:1-9.
16. Khadjooi K, Foley P, Anthony J, Chalil S, Smith R, Frenneaux M, Leyva F. Long-term effects of cardiac resynchronisation therapy in patients with atrial fibrillation. Heart 2008;94:879-883.
17. Gasparini M, Auricchio A, Metra M, et al.on behalf of the Multicentre Longitudinal Observational Study (MILOS) Group. Long-term survival in patients undergoing cardiac resynchronization therapy: the importance of atrio-ventricular junction ablation in patients with permanent atrial fibrillation. Eur Heart J 2008;29:1644-1652.
18. Cleland JGF, Cullington D, Khaleva O, Tageldien A. Cardiac resynchronization therapy: dyssynchrony imaging from a heart failure perspective. Curr Opin Cardiol 2008; 23:634-645.
19. Yu CM, Bleeker GB, Fung JW, et al. Left ventricular reverse remodeling but not clinical improvement predicts long-term survival after cardiac resynchronization therapy. Circulation 2005; 112:1580-1586.
20. Yu CM, Fung WH, Lin H, Zhang Q, Sanderson JE, Lau CP. Predictors of left ventricular reverse remodeling after cardiac resynchronization therapy for heart failure secondary to idiopathic dilated or ischemic cardiomyopathy. Am J Cardiol 2003; 91:684-688.
21. Bax JJ, Marwick TH, Molhoek SG, et al. Left ventricular dyssynchrony predicts benefit of cardiac resynchronization therapy in patients with end-stage heart failure before pacemaker implantation. Am J Cardiol 2003; 92:1238-1240.
22. Yu CM, Chan YS, Zhang Q, et al. Benefits of cardiac resynchronization therapy for heart failure patients with narrow QRS complexes and coexisting systolic asynchrony by echocardiography. J Am Coll Cardiol 2006; 48:2251-2257.
23. Yu CM, Lin H, Zhang Q, Sanderson JE. High prevalence of left ventricular systolic and diastolic asynchrony in patients with congestive heart failure and normal QRS duration. Heart 2003; 89:54-60.
24. Bax JJ, Abraham T, Barold SS, et al. Cardiac Resynchronization Therapy: Part 1--Issues Before Device Implantation. J Am Coll Cardiol 2005;46:2153-2167.
25. Bax JJ, Bleeker GB, Marwick TH, et al. Left ventricular dyssynchrony predicts response and prognosis after cardiac resynchronization therapy. J Am Coll Cardiol 2004; 44:1834-1840.
26. Chung ES, Leon AR, Tavazzi L, et al. Results of the Predictors of Response to CRT (PROSPECT) Trial. Circulation 2008;117:2608-2616.
27. Yu CM, Bax JJ, Gorcsan III J. Critical appraisal of methods to assess mechanical dyssynchrony. Curr Opin Cardiol 2009;24:18-28.
28. Gorcsan III J, Abraham T, Agler DA, et al. Echocardiography for Cardiac Resynchronization Therapy: Recommendations for Performance and Reporting-A Report from the American Society of Echocardiography Dyssynchrony Writing Group Endorsed by the Heart Rhythm Society. J Am Soc Echocardiogr 2008; 21:191-213.
29. Marwick TH. Hype and Hope in the Use of Echocardiography for Selection for Cardiac Resynchronization Therapy: The Tower of Babel Revisited. Circulation 2008; 117:2573-2576.
30. Miyazaki C, Powell BD, Bruce CJ, et al. Comparison of Echocardiographic Dyssynchrony Assessment by Tissue Velocity and Strain Imaging in Subjects With or Without Systolic Dysfunction and With or Without Left Bundle-Branch Block. Circulation 2008; 117:2617-2625.
31. Van Bommel RJ, Delgado V, Ypenburg C, et al. Left Ventricular Dyssynchrony Measured by Speckle-Tracking Radial Strain Analysis Predicts Survival After Resynchronization Therapy. Circulation 2008;118:S8678 (abstract).
32. Soliman OII, Theuns DAMJ, Geleijnse ML, et al. Spectral pulsed-wave tissue Doppler imaging lateral-to-septal delay fails to predict clinical or echocardiographic outcome after cardiac resynchronization therapy. Europace 2007;9:113-118.
33. Conca C, Faletra FF, Miyazaki C, et al. Echocardiographic Parameters of Mechanical Synchrony in Healthy Individuals. Am J Cardiol 2009;103:136-142.
34. De Boeck BWL, Meine M, Leenders GE, et al. Practical and conceptual limitations of tissue Doppler imaging to predict reverse remodelling in cardiac resynchronisation therapy. Eur J Heart Fail 2008;10:281-290.
35. Marwick TH. Measurement of Strain and Strain Rate by Echocardiography: Ready for Prime Time?. J Am Coll Cardiol 2006;47:1313-1327.
36. Fauchier L, Marie O, Casset-Senon D, et al. Interventricular and intraventricular dyssynchrony in idiopathic dilated cardiomyopathy. A prognostic study with Fourier phase analysis of radionuclide angioscintigraphy. J Am Coll Cardiol 2002;40:2022-2030.
37. Henneman MM, Chen J, Ypenburg C, et al. Phase Analysis of Gated Myocardial Perfusion Single-Photon Emission Computed Tomography Compared With Tissue Doppler Imaging for the Assessment of Left Ventricular Dyssynchrony. J Am Coll Cardiol 2007; 49:1708-1714.
38. Henneman MM, Chen J, Dibbets-Schneider P, et al. Dyssynchrony as Assessed with Phase Analysis on Gated Myocardial Perfusion SPECT Predict Response to CRT?. J Nucl Med 2007; 48:1104-1111.
39. Trimble MA, Borges-Neto S, Honeycutt EF, et al. Evaluation of mechanical dyssynchrony and myocardial perfusion using phase analysis of gated SPECT imaging in patients with left ventricular dysfunction. J Nucl Cardiol 2008;15:663-670.
40. Bleeker GB, Kaandorp TAM, Lamb HJ, et al. Effect of posterolateral scar tissue on clinical and echocardiographic improvement after cardiac resynchronization therapy. Circulation 2006;113:969-976
41. White JA, Yee R, Yuan X, et al. Delayed enhancement magnetic resonance imaging predicts response to cardiac resynchronization therapy in patients with intraventricular dyssynchrony. J Am Coll Cardiol 2006;48:1953-1960.
42. Sciagra R, Giaccardi M, Porciani MC, et al. Myocardial perfusion imaging using gated SPECT in heart failure patients undergoing cardiac resynchronization therapy. J Nucl Med 2004;45:164-168.
43. Ypenburg C, Schalij MJ, Bleeker GB, et al. Impact of viability and scar tissue on response to cardiac resynchronization therapy in ischaemic heart failure patients. Eur Heart J 2007;28:33-41.
44. Adelstein EC, Saba S. Scar burden by myocardial perfusion imaging predicts echocardiographic response to cardiac resynchronization therapy in ischemic cardiomyopathy. Am Heart J 2007;153:105-112.
45. Truong QA, Singh JP, Cannon CP, et al. Quantitative Analysis of Intraventricular Dyssynchrony Using Wall Thickness by Multidetector Computed Tomography. J Am Coll Cardiol Img 2008; 1:772-781.
46. Chalil S, Stegemann B, Muhyaldeen S, et al. Intraventricular Dyssynchrony Predicts Mortality and Morbidity After Cardiac Resynchronization Therapy: A Study Using Cardiovascular Magnetic Resonance Tissue Synchronization Imaging. J Am Coll Cardiol 2007;50:243-252.
47. Lardo AC, Abraham TP, Kass DA. Magnetic Resonance Imaging Assessment of Ventricular Dyssynchrony: Current and Emerging Concepts. J Am Coll Cardiol 2005;46:2223-2228.
48. Wyman BT, Hunter WC, Prinzen FW, et al. Mapping propagation of mechanical activation in the paced heart with MRI tagging. Am J Physiol 1999;276:H881-H891.
49. Helm RH, Lecquercq C, Faris Q, et al. Cardiac dyssynchrony analysis using circumferential versus longitudinal strain: Implications for assessing cardiac resynchronization. Circulation 2005;111:2760-2767.
50. Westenberg JJM, Lamb H, van der Geest RJ, et al. Assessment of left ventricular dyssynchrony in patients with conduction delay and idiopathic dilated cardiomyopathy. J Am Col Cardiol 2006;47:2042-2048.
51. Auricchio A, Fantoni C, Regoli F, et al. Characterization of left ventricular activation in patients with heart failure and left bundle-branch block. Circulation 2004;109:1133-1139.
52. Fung JWH, Yu CM, Yip G, et al. Variable left ventricular activation pattern in patients with heart failure and left bundle branch block. Heart 2004;90:17-19.
53. Fung JWH, Chan JYS, Yip GWK, et al. Effect of left ventricular endocardial activation pattern on echocardiographic and clinical response to cardiac resynchronization therapy. Heart 2007;93:432-437.
54. Schilling RJ. Non-contact mapping of the left ventricle and new insights into the mechanisms for success of biventricular pacing. Heart 2004;90:3-4.
55. Lambiase PD, Rinaldi A, Hauck J, et al. Non-contact left ventricular endocardial mapping in cardiac resynchronisation therapy. Heart 2004;90:44-51.
|


